由下列实验事实所得出的相应结论的因果关系正确的是
| |
实验事实 |
结论 |
| A |
Cl2的水溶液可以导电 |
Cl2是电解质 |
| B |
SO2通入硝酸钡溶液出现白色沉淀 |
BaSO3不溶于强酸 |
| C |
将CO2通入NaAlO2溶液会产生白色沉淀 |
结合H+的能力:HCO3-<AlO2- |
| D |
常温下白磷可自燃而氮气须在放电时才与氧气反应 |
非金属性:P>N |
将一定体积的稀硝酸平均分成两份,在其中一份中加入足量铜粉,生成的气体在标准状况下的体积为V1;在另一份中先加入与其体积相等的稀硫酸,再加入足量铜粉同,生成的气体在标准状况下的体积为V2,已知V2=3V1。则稀硝酸和稀硫酸的物质的量浓度之比为()
| A.1:1 | B.1:2 | C.1:3 | D.1:4 |
已知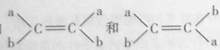 (a、b分别代表不同的原子或原子团)互为同分异构体。据此推断一氯丙烯的同分异构体(不含环状结构)共有()
(a、b分别代表不同的原子或原子团)互为同分异构体。据此推断一氯丙烯的同分异构体(不含环状结构)共有()
| A.3种 | B.4种 | C.5种 | D.6种 |
下列关于有机物的说法中,不正确的是()
| A.甲烷、苯、乙醇都能发生取代反应 |
| B.乙烯使溴水和酸性高猛酸钾溶液褪色的反应类型相同 |
| C.油脂在碱性条件下的水解反应是工业制肥皂的原理 |
| D.银氨溶液或新制Cu(OH)2均能检验糖尿病人尿液中的葡萄糖 |
下列离子方程式书写正确的是()
| A.用FeC13溶液腐蚀铜线路板:Cu+Fe3+ |
| B.往氢氧化钠溶液中通入少量二氧化硫:SO2+OH— |
| C.NaHCO3溶液与过量Ba(OH)2溶液反应:HCO3—+Ba2++OH— |
| D.酸性条件下K1O3溶液与KI反应生成I2:IO3—+5I—+3H2O |
设NA为阿伏加德罗常数的值,下列说法正确的是()
| A.7.8g Na2O2含有的阴离子数目为0.2NA |
B.标准状况下,VL水含有的氧原子数目约为 |
| C.14g乙烯和丙烯(C3H6)的混合物中含有的原子数目为3NA |
| D.1L 0.5mol/L Na2CO3溶液中含有的CO32—数目为0.5NA |