相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
2NH3(g)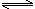 N2(g)+3H2(g) △H=+92.4kJ/mol
N2(g)+3H2(g) △H=+92.4kJ/mol
实验测的起始、平衡时的有关数据如下表:
| 容器编号 |
起始时各物质物质的量/mol |
平衡时反应中的能量变化 |
||
| NH3 |
N2 |
H2 |
||
| ① |
2 |
0 |
0 |
吸收热量akJ |
| ② |
0 |
1 |
3 |
放出热量bkJ |
| ③ |
4 |
0 |
0 |
吸收热量ckJ |
下列叙述正确的是
A.热量关系:a=b
B.反应的平衡常数:③>①>②
C.达平衡时H2的体积分数:①>③
D.①中的密度不再改变时说明反应已达到平衡状态
有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl―完全沉淀,反应中消耗x molH2SO4 ,y molAgNO3。则原溶液中的钠离子浓度为()
| A.(y -2 x)/a | B.(y–x)/a | C.(2y -2 x)/a | D.(2y -4x)/a |
在两个密闭容器中,分别充有质量相等的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是()
| A.甲的分子数比乙的分子数多 |
| B.甲的物质的量比乙的物质的量少 |
| C.甲的气体摩尔体积比乙的气体摩尔体积小 |
| D.甲的相对分子质量比乙的相对分子质量少 |
将11.5克钠投入足量水中得到溶液a;将12克镁投入到足量的与上述水等质量的盐酸中,得到溶液b。则a与b的质量关系是()
| A.a等于b | B.a小于b | C.a大于b | D.无法比较 |
阿伏加德罗常数约为6.02×1023mol-1。下列叙述中正确的是()
| A.32 g含有少量臭氧的氧气中,共含有氧原子数为2×6.02×1023 |
| B.标准状况下,11.2 L四氯化碳含有的分子数为0.5×602×1023 |
| C.5.6 g铁粉完全溶于硝酸,失去的电子数一定为0.3×6.02×1023 |
| D.1 L0.5mol/L Na2CO3溶液中含有的CO32-数目为0.5×6.02×1023 |
M、N两溶液分别含有下列十二种离子中的五种和七种离子:K+、Na+、H+、NH4+、Fe3+、 A13+、Cl―、OH―、NO3―、S2―、CO32―、SO42―。己知两溶液所含离子各不相同,M溶液里的阳离子只有两种,则N溶液里的阴离子应该是()
| A.Cl―、SO42―、NO3― | B.S2―、Cl―、SO42― |
| C.CO32―、NO3―、S2― | D.OH―、CO32―、SO42― |