氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇,熔点422 ℃,沸点1366 ℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗盐水(含Ca2+、Mg2+、SO42-等杂质)、Cu、稀硫酸、SO2等为原料合成CuCl的工艺如下: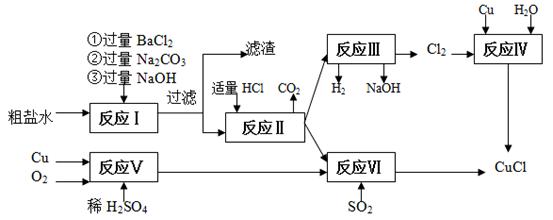
(1)在粗盐除杂的反应I中加Na2CO3溶液的作用是 ;
滤渣的主要成分: 。
(2)反应Ⅱ完成后溶液中主要溶质是 。
(3)反应IV和VI都是制备CuCl的化学过程:
①反应IV加入的Cu必须过量,其目的是 。
②写出反应VI的离子方程式 。
(4)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70 ℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是 。
下列物质①铁②干冰③金刚石④铜⑤水晶⑥氯化钠⑦单质碘⑧氢氧化钠【请用编号回答(1)和(2)小题】
(1)属于离子晶体的是,属于分子晶体的是,属于原子晶体的是,属于金属晶体的是;
(2)只含共价键(不含分子间作用力)的化合物是,只含离子键的是,既含共价键又含离子键的是;
(3)写出电子式:干冰,氢氧化钠。
(4)写出结构式:干冰,单质碘
在浓硝酸中放入铜片:
(1)反应开始时,实验现象为。
反应的化学方程式为;
(2)反应结束后,若铜有剩余,反应接近结束时的化学反应方程式为:
;
某化学兴趣小组同学进行如下实验。
(1)使用铜和稀硫酸制备硫酸铜晶体。步骤如下: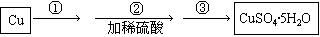
步骤①观察到的现象是:。
步骤③的主要操作包括:。
(2)某同学查资料知:铜与稀硫酸不反应,若在稀硫酸中加入H2O2,铜可逐渐溶解。实验装置如图,写出该反应的化学方程式:。
(3)铜粉放入稀硫酸中,加热后无明显现象发生。当加入一种物质后,铜粉开始溶解,溶液变蓝色,同时有气体逸出,该物质是(填字母);
| A.Al2(SO4)3 | B.Na2CO3 | C.KNO3 | D.FeSO4 |
写出该反应的离子方程式。
在不同温度下,反应CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数K如下表:
CO(g)+H2O(g)的平衡常数K如下表:
| 温度/℃ |
700 |
800 |
850 |
1000 |
1200 |
| 平衡常数K |
2.6 |
1.7 |
1 |
0.9 |
0.6 |
(1)该反应的△H0。(填“>”、“=”或“<”)。若到达平衡后升高温度,则CO2的转化率将,正反应速率(填“增大”、“减小”或“不变”)。
(2)850℃时发生上述反应,CO2的转化率随时间变化如图所示。其他条件相同时,请在下图中画出700℃时CO2的转化率随时间变化的示意图(注明必要的标示)。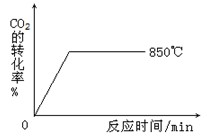
(3)在850℃时发生上述反应,以下表中的物质的量投入恒容反应器,其中向正方向移动的组是(填代号),平衡后与C中各物质的百分含量相等的组有__________(填代号 )
| A |
B |
C |
D |
E |
|
| n(CO2)[ |
3 |
1 |
0 |
1 |
1 |
| n(H2) |
2 |
1 |
0 |
1 |
2 |
| n(CO) |
1 |
2 |
3 |
0.5 |
3 |
| n(H2O) |
5 |
2 |
3 |
0.5 |
1 |
(4) 850℃时,在1L的密闭容器中分别充入2mol的CO2和H2,计算反应到达平衡时CO的物质的量浓度。(写出计算过程)
现有反应:mA(g) + nB(g)  pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1) 该反应的正反应为 ________反应(填吸热或放热),△S_____0 (填“>”、“=”或“<”),由此判断,此反应自发进行的条件为_______。
A 一定自发 B一定不自发 C高温自发,低温不自发 D低温自发,高温不自发
(2) 减压时,A的质量分数_________。(填“增大”、“减小”或“不变”,下同)
(3) 若加入B (体积不变),则A的转化率_________。
(4) 若升高温度,则平衡时B、C的浓度之比C(B) :C(C) 将_________。
(5) 若加入催化剂,平衡时气体混合物的总物质的量_______。
(6) 若B是有色物质,A、C均无色,则加入C (体积不变)后混合物颜色_______;(填“变深”、“变浅”或“不变”,下同)
(7)维持容器内压强不变,充入氖气后,混合物颜色。