常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A.1.0 mol·L-1 KNO3溶液:H+、Fe2+、SCN−、SO42− |
| B.pH=0的溶液:Al3+、Ag (NH3)2+、Cl−、SO42− |
| C.c(H+)/c(OH−)=10−10的溶液:K+、Ba2+、NO3−、Cl− |
| D.c( ClO− )=1.0 mol·L−1的溶液:Na+、SO32−、S2−、SO42− |
HPE是合成除草剂的重要中间体,其结构简式如下图所示。下列有关HPE的说法不正确的是 ( )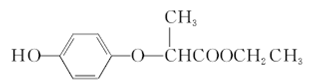
| A.含1 mol HPE的溶液最多可以和2 mol NaOH反应 |
| B.HPE能跟浓溴水反应产生白色沉淀 |
| C.该化合物在核磁共振氢谱上显示有5组特征峰 |
| D.该物质为芳香族化合物,分子式为C11H12O4 |
下列关于有机化合物的认识正确的是( )
| A.天然油脂是高分子化合物,同时也是混合物 |
| B.淀粉、纤维素的分子式都是(C6H10O5)n,二者互为同分异构体 |
| C.氨基酸和蛋白质分子中都含有氨基和羧基,二者均有两性 |
| D.糖类、油脂、蛋白质均能发生水解 |
常温下,下列各组离子在所给条件下能够大量共存的是( )
A.酸性环境下的无色透明溶液中:Na+、Cu2+、NO 、SO 、SO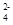 |
B.c(H+)=10-14mol·L-1的溶液中:Na+、AlO 、S2-、SO 、S2-、SO |
C.能与金属铝反应放出氢气的溶液:Fe2+、SO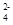 、NO 、NO 、Na+ 、Na+ |
D.使pH试纸显红色的溶液中:Cu2+、Fe3+、NO 、SO 、SO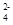 |
某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:铜铝混合物 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中正确的是( )
| A.溶液A和B均可以是盐酸或NaOH溶液 |
| B.若溶液B选用浓硝酸,则测得铜的质量分数偏大 |
| C.溶液A和B均可选用稀硝酸 |
| D.实验室中方案Ⅱ更便于实施 |
已知下列热化学方程式:
Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g)ΔH=-24.8 kJ/mol
Fe2O3(s)+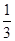 CO(g)===
CO(g)===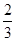 Fe3O4(s)+
Fe3O4(s)+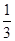 CO2(g)ΔH=-15.73 kJ/mol
CO2(g)ΔH=-15.73 kJ/mol
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g)ΔH=+640.4 kJ/mol
则14 g CO气体还原足量FeO固体得到Fe单质和CO2气体时对应的ΔH约为( )
| A.-218 kJ/mol | B.-109 kJ/mol | C.+218 kJ/mol | D.+109 kJ/mol |