用惰性电极电解某金属元素R的硝酸盐R(NO3)n溶液,通电一段时间后,阳极产生气体V L(标准状况)时,阴极质量增加m g,若R的相对原子质量为M,设NA为阿伏加德罗常数的值,下列叙述中不正确的是
A.电路中通过电子 NA NA |
B.n =  |
C.溶液中H+增加 NA NA |
D.n =  |
在标准状况下,2.24 L Cl2通入足量的NaOH溶液中,充分反应后,生成NaClO的物质的量为()
| A.0.2 mol | B.0.1 mol | C.2 mol | D.1 mol |
200 ℃时,11.6 g CO2和水蒸气的混合气体与足量的Na2O2充分反应,反应后固体质量增加了3.6 g,则原混合气体的平均式量为()
| A.5.8 | B.11.6 | C.23.2 | D.46.4 |
标准状况下,6.72 L Cl2和元素R完全反应,生成0.2 mol RCln,则n值是( )
| A.1 | B.2 | C.3 | D.4 |
配制100 mL 0.1 mol·L-1 Na2CO3溶液,下列操作正确的是()
| A.称取10.6 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容 |
| B.称取10.6 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解 |
| C.转移Na2CO3溶液时,未用玻璃棒,直接倒入容量瓶 |
| D.定容后,塞好瓶塞,反复倒转,摇匀 |
图中横坐标表示完全燃烧时耗用可燃气体X(X=A、B、C)的物质的量n(X),纵坐标表示消耗O2的物质的量n(O2),A、B是两种可燃气体,C是A和B的混合气体,则C中n(A)∶n(B)为()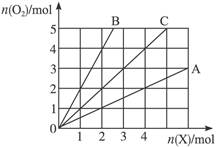
A.2∶1 B.1∶2 C.1∶1 D.任意比