Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.
(1)不法分子常用黄铜制成金光闪闪的“假元宝”蒙骗人们.下列鉴别方法中错误的是 。
| A.看颜色 | B.灼烧 | C.加硝酸银溶液 | D.加盐酸 |
(2)为了测定某铜锌合金的组成,校化学课外活动小组利用该合金粉末与稀硫酸反应,设计了如图所示的实验装置进行实验。
①检查装置气密性的方法是:连接好装置,从漏斗注水,量气管两边形成高度差,做好标记,一段时间后,高度差 ,说明气密性良好。
②正确读取量气管内液面的初始、最终读数前都需进行的操作是 。③该小组进行了三次实验,所得相关的实验数据处理如下:
| |
合金的质量/g |
稀硫酸的体积/mL |
生成氢气的质量/g |
| 第1次 |
2 |
15 |
0.04 |
| 第2次 |
2 |
20 |
0.04 |
| 第3次 |
4 |
15 |
0.04 |
a、列式计算2g合金中,锌的质量: 。
b、分析上表数据,第 次实验,合金中的锌与稀硫酸恰好完全反应,稀硫酸的溶质质量分数为 (结果保留到0.1%)。(实验温度下,ρ(H2SO4)=1.08g/cm3)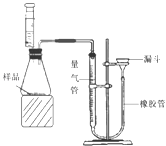
某工厂需要
氢气制备高纯度硅。若用电解水的方法制取这些氢气,需消耗水的质量是多少?(
↑
↑)
根据质量守恒定律,6 g镁和8 g氧气充分反应,可生成14 g氧化镁。这种说法正确吗?为什么?如不正确,请加以改正
用100克KClO3和MnO2的混合物制取氧气,反应前测得MnO2占混合物总质量的25%,反应一段时间后,又测得MnO2占30%。求:此时分解的KClO3的质量是多少?制得的氧气的质量是多少?
一定质量的镁和碳酸镁混合物,经高温煅烧,直到质量不再变化为止。发现反应前后总质量不变,求原混合物中镁粉的质量分数
氢氧化钠潮解后极易与二氧化碳反应而变质.为测定实验室里一瓶放置已久的烧碱中氢氧化钠的质量分数,某同学取 烧碱样品放在小烧杯中,然后加入 稀硫酸,恰好完全反应,反应后所得溶液的质量为 .计算该烧碱样品中氢氧化钠的质量分数.