为了检验市场上常见两种金属饮料瓶的主要成分,某小组取甲、乙两种饮料瓶,将其剪碎作为样品,分别按下述步骤进行实验:
I.取少量样品于试管中,加入盐酸,充分反应后过滤。
II.取少量滤液于试管中,向其中滴加氢氧化钠溶液。
步骤II的实验现象如下:
| 样品甲 |
生成白色沉淀,继续滴加氢氧化钠溶液,沉淀消失 |
| 样品乙 |
生成白色沉淀,白色沉淀迅速变为灰绿色,最终变为红褐色 |
(1)样品甲中金属的主要成分是 ,生成白色沉淀反应的离子方程式是 。
(2)样品乙进行步骤I后所得滤液中一定含有的金属离子是 ,白色沉淀变为红褐色反应的化学方程式是 。
某同学称取了4.0 gNaOH固体,欲配制100 mL溶液。回答下列问题:
(1)该实验中,用到的能确定体积的两种玻璃仪器是________、________。
(2)操作过程中多次用到玻璃棒,其在实验中的作用有_____。
(3)不规范的实验操作会导致实验结果的误差。分析下列操作对实验结果的影响(填“偏大”、“偏小”或“不变”):
①在溶解过程中有少量液体溅出烧杯外________;
②定容时仰视仪器上的刻度线________;
③定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线________。
(4)最后所得的溶液应存放在试剂瓶中,并贴上标签,请你填写该标签(如图)。
某小组同学将一定浓度NaHCO3溶液加入到CuSO4溶液中发现生成了沉淀。甲同学认为沉淀是CuCO3;乙同学认为沉淀是CuCO3和Cu(OH)2的混合物,他们设计实验测定沉淀中CuCO3的质量分数。
(1)按照甲同学的观点,发生反应的离子方程式为
(2)两同学利用下图所示装置进行测定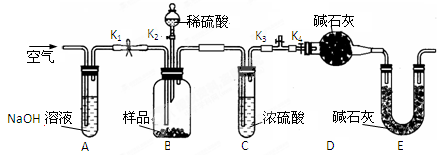
①在研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为、洗涤、干燥。
②装置E中碱石灰的作用是。
③实验过程中有以下操作步骤:
a.关闭K1、K3,打开K2、K4,充分反应
b.打开K1、K4,关闭K2、K3,通入过量空气
c.打开K1、K3,关闭K2、K4,通入过量空气
正确的顺序是(填选项序号,下同)。
④若沉淀样品的质量为m g,装置D的质量增加了n g,则沉淀中CuCO3的质量分数为。
某化学实验小组同学为了证明、比较SO2和氯水的漂白性,设计了如下图所示的实验装置。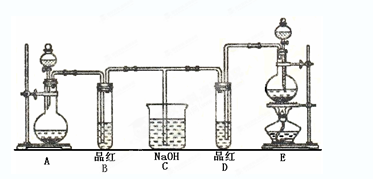
(1) 实验室常选用制CO2的发生装置制SO2;实验室在用MnO2跟浓盐酸反应制备Cl2时,应选用上图A、E两发生装置中装置(填装置序号)制Cl2。
(2) 反应开始后,发现B、D两个试管中的品红溶液都褪去,停止通气后,给B、D两个试管加热,两个试管中的现象分别为B: ,D: 。
(3) 装置C的作用是 。
(4) 甲乙两名同学分别利用下图所示装置探究两种气体按不同比例混合后的漂白性。试分析: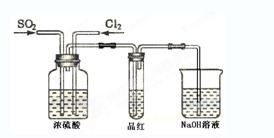
①在气体进入品红溶液之前,先将SO2和Cl2通过盛有浓硫酸装置的目的是:
。
②甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是: ,并写出其相应的离子方程式: 。
③乙同学在实验过程中发现:通气一段时间后,品红溶液颜色随时间推移变得越来越浅,其原因是: 。
NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于在细胞和细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
(1)实验室用金属铜和稀硝酸制取NO的离子方程式为
________________________________________________________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。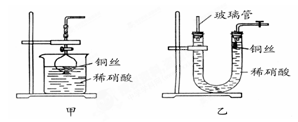
打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是_________________________________(写化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始时,可以在U形管右端观察到无色的NO气体。长玻璃管的作用是_______________________________________。
(4)假设实验中12.8 g Cu全部溶解,需要通入标准状况下________L O2才能使NO全部溶于水。
(5)用金属铜制取硝酸铜,从节约原料和防止环境污染的角度考虑,下列4种方法中最好的是________(填“甲”“乙”“丙”或“丁”),理由是__________________________________。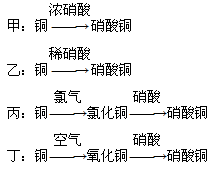
某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。为此,他们设计了如下装置验证所产生的气体。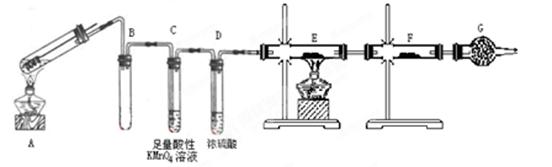
(1)填写装置的作用:B ,C,G。
(2)先点燃处酒精灯(填“A”或“E”),点燃E处酒精灯前一步操作。
(3)证明有SO2生成的现象是。
(4)可以证明气体X中含有氢气的实验现象是:________________________。如果去掉装置D,还能否根据F中的现象判断气体中有氢气?________(填“能”或“不能”),原因是__________________________。
(5)反应后A的溶液中含有Fe3+和Fe2+,检验其中的Fe2+的方法是。