已知298 K,101 kPa时,2SO2(g)+O2(g) 2SO3(g) ΔH=-197 kJ·mol-1。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,达到平衡时放出热量为Q2,则下列关系正确的是
2SO3(g) ΔH=-197 kJ·mol-1。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,达到平衡时放出热量为Q2,则下列关系正确的是
| A.Q2<Q1<197 kJ·mol-1 | B.Q2=Q1=197 kJ·mol-1 |
| C.Q1<Q2<197 kJ·mol-1 | D.Q2=Q1<197 kJ·mol-1 |
下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是 ()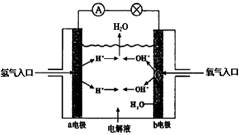
| A.a电极是负极 |
| B.b电极的电极反应为:4OH--4e-=2H2O+O2 |
| C.氢氧燃料电池是一种具有应用前景的绿色电源 |
| D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置 |
关于如图所示装置的叙述,正确的是()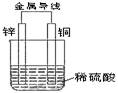
| A.铜是阳极,铜片上有气泡产生 | B.铜片质量逐渐减少 |
| C.电流从锌片经导线流向铜片 | D.氢离子在铜片表面被还原 |
原电池的正极一定是()
| A.电子流出的极 | B.电子流入的极 |
| C.发生氧化反应的极 | D.电极自身参与反应的极 |
铁片和锌片用导线连接后插入稀硫酸中,铁片是()
| A.负极 | B.正极 | C.阳极 | D.阴极 |
深海鱼油是从深海鱼的脂肪中提取出来的鱼油,其有效成分主要是DHA(二十二碳六烯酸)和EPA(二十碳五烯酸)。下列对深海鱼油的叙述中错误的是( )
| A.可使溴水褪色 |
| B.是一种脂肪,属油脂类 |
| C.可与Na2C03溶液反应 |
| D.是不饱和脂肪酸 |