下图为一原电池装置,下列叙述中正确的是
| A.铜是阳极,铜片上有气泡产生 |
| B.盐桥中的K+ 移向ZnSO4溶液 |
| C.电流从锌片经导线流向铜片 |
| D.铜离子在铜片表面被还原 |
向含有Fe2+、I-、Br-的溶液中缓慢通入氯气,溶液中各种离子的物质的量变化如图所示。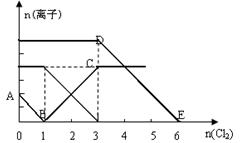
下列说法正确的是
| A.B点时溶液中含有I-和Br- |
B.DE段表示n (F e2+)的变化情况 e2+)的变化情况 |
| C.原溶液中n (Fe2+) :n (I-) :n (Br-) =" 3" :1 :2 |
| D.当通入2mol Cl2时,溶液中发生的离子反应是:2Fe2+ + 2I- + 2Cl2 = 2Fe3+ + I2 + 4 Cl- |
常温下,向 20 mL 0.1 mol·L-1CH3COOH溶液中滴加0.1 mol·L-1NaOH溶液。下列说法正确的是
| A.当溶液的pH=7时:c(Na+) = c(CH3COO-) + c(CH3COOH) |
| B.当加入10 mL 0.1 mol·L-1NaOH溶液时:c(CH3COO-) +2 c(OH-) = c(CH3COOH) + 2c(H+) |
| C.当加入20 mL 0.1 mol·L-1NaOH溶液时:c(Na+) >c(OH-) >c(CH3COO-) > c(H+) |
| D.滴定过程中可能有:c(CH3COOH) >c(H+) >c(CH3COO-) >c(Na+) >c(OH-) |
常温下用石墨电极电解1L 0.01 mol·L-1NaCl溶液,电解一段时间后,阴极产生0.04g气体。下列说法正确的是(假设电解过程中溶液体积不变)
| A.电解过程中有0.02mol电子转移 |
| B.阳极产物只有氯气 |
| C.在标准状况下,阳极产生的气体体积为0.448L |
| D.电解后溶液的pH =12 |
X、Y、Z、W为四种短周期非金属元素,其中X单质是一种重要的半导体材料, X、Y、Z同周期,且原子序数依次增大,Y、W同主族,离子半径Y2->W2-。
下列说法正确的是:
| A.X的非金属性比Y的强 |
| B.X和W组成的化合物化学性质活泼,与盐酸和氢氧化钠溶液都能反应 |
| C.Y的气态氢化物不如Z的气态氢化物稳定 |
| D.某溶液中通入Z的单质后再滴加淀粉溶液显蓝色,原溶液中一定含有I- |
现有四种短周期元素的原子半径及主要化合价数据如下表所示:
| 元素 |
甲 |
乙 |
丙 |
丁 |
| 原子半径/nm |
0.186 |
0.102 |
0.152 |
0.074 |
| 主要化合价 |
+1 |
+6、¯2 |
+1 |
¯2 |
下列叙述不正确的是
A.甲单质的熔点比丙单质的熔点高
B.甲单质可用电解其熔融盐的方法冶炼而得
C.常温下,丁的两种氢化物均为液体
D.乙的简单离子是四种元素各自形成的简单离子中半 径最大的
径最大的