分子式为C5H10N2O3的二肽在酸性条件下可水解为氨基酸(不考虑H2N-COOH和立体异构),这些氨基酸重新组合可形成的二肽共有
| A.3种 | B.6种 | C.9种 | D.12种 |
高温下焙烧CuFeS2的反应之一为2CuFeS2+7O2=CuSO4+CuO+Fe2O3+3SO2,下列关于该反应的叙述正确的是
| A.CuFeS2中硫的化合价为-1 |
| B.CuFeS2发生还原反应 |
| C.1 mol CuFeS2完全反应转移13 mol电子 |
| D.CuSO4和SO2既是氧化产物,又是还原产物 |
化学与人类生活、社会可持续发展密切相关。下列有关说法正确的是
①高空臭氧层吸收太阳紫外线,保护地球生物;低空过量臭氧是污染气体,对人体有危害
②加大铅酸蓄电池、含汞锌锰干电池的生产,满足消费需求
③PM2.5表示每立方米空气中直径小于或等于2.5微米的颗粒物的含量,PM2.5值越高,大气污染越严重
④用氨水法处理燃煤烟气中的二氧化硫,即可消除其污染,又可得到副产品硫酸铵
⑤过度使用尿素[CO(NH2)2]会使土壤碱化,可用石灰加以改良
| A.①②⑤ |
| B.①③④ |
| C.②④⑤ |
| D.①③⑤ |
下列有关化学用语表示正确的是
| A.乙醛的结构简式:CH3COH |
B.H2O2的电子式: |
C.次氯酸的电子式: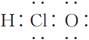 |
D.亚硫酸钠水解的离子方程式:SO32-+2H2O H2SO3+2OH- H2SO3+2OH- |
关于下列各图的叙述,正确的是

A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6 kJ·mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2(g)  N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液的pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液