在反应3Cl2+8 NH3 = N2+6NH4Cl中,氧化剂与还原剂的物质的量之比为( )
| A.8:3 | B.3:8 | C.3:2 | D.1:3 |
右图表示可逆反应A(固)+B(气) nC(气);△H=Q(n为正整数)在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。
nC(气);△H=Q(n为正整数)在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。
下列有关叙述中一定正确的是()
| A.其他条件相同,a表示使用了催化剂,b没有使用催化剂 |
| B.其他条件相同,若只改变温度,则a比b的温度高且△H>0 |
| C.其他条件相同,若只改变压强,则a比b的压强大且n≥2 |
| D.其他条件相同,若改变A的物质的量,则a比b用A的物质的量少 |
下列离子方程式正确的是()
| A.NaHCO3溶液和NaOH溶液混合HCO3-+OH- |
| B.将少量的二氧化硫气体通入氯化钙溶液中SO2+H2O+Ca2+ |
| C.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O |
| D.铜片与稀HNO3反应:3Cu+2NO3-+8H+ |
下列化学用语表示正确的是()
A.氯化钠的电子式为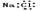 |
B.次氯酸的电子式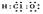 |
| C.二氧化碳的结构式为O=C=O |
| D.NaHCO3的电离方程式为NaHCO3=Na++H++CO32- |
下列叙述正确的是()
| A.18gD2O中含有的质子数为10×6.02×1023个 |
| B.1mol碳正离子(CH5+)中含电子数为10×6.02×1023个 |
| C.44gC3H8分子中含共价键数为11×6.02×1023个 |
| D.1Lmol·L-1醋酸溶液中离子总数为2×6.02×1023个 |
下列各组离子能在指定溶液中肯定大量共存的是()
①无色溶液中:K+、Na+、Cu2+、Cl-、SO42-
②pH>7的溶液中:CO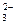 、NO3-、Na+、S2-、AlO2-、SO32-
、NO3-、Na+、S2-、AlO2-、SO32-
③水电离出的c(H+)=10-12mol·L-1的溶液中:HCO3-、NO3-、NH4+、Fe2+
④加入Al能放出H2的溶液中:Mg2+、NH4+、Cl-、Na+、CO32-
⑤pH=1的溶液中:MnO4-、NO3-、SO42-、Na+、Fe3+
| A.②③④ | B.①④⑤ | C.②⑤ | D.③⑤ |