根据反应式:①2Fe3++2I- 2Fe2++I2和② Br2+2Fe2+
2Fe2++I2和② Br2+2Fe2+ 2Fe3++ 2Br-,可判断离子的还原性从强到弱的顺序是( )
2Fe3++ 2Br-,可判断离子的还原性从强到弱的顺序是( )
| A.Br-、Fe2+、I- | B.I-、Fe2+、Br- |
| C.Br-、I-、Fe2+ | D.Fe2+、I-、Br- |
铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质问的反应,其中对应的离子方程式书写正确的是( )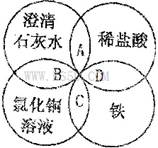
A、OH-+HCl=H2O+Cl-B、Ca(OH)2+Cu2+=Ca2++Cu(OH)2
C、Fe+Cu2+=Cu+Fe2+ D、Fe+2H+=Fe3++H2↑
设NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A.22.4LCO和CO2的混合气体中所含的碳原子数一定是NA |
| B.常温常压下,32gO2和32gO3所含氧原子数都是2NA |
| C.1molFe与足量盐酸反应,Fe所失去的电子数为3NA |
| D.l00mL l mol/L NaCl溶液与50 mL 1 mol/L AlCl3溶液中Cl-物质的量浓度相等 |
在某无色透明的酸性溶液中,能共存的离子组是( )
| A.Na+、K+、SO42-、CO32- | B.Na+、K+、Cl-、NO3- |
| C.Cu2+、K+、SO42-、NO3- | D.Ba2+、K+、SO42-、Cl- |
同温同压下,等质量的N2O4和NO2两种气体相比较,下列叙述正确的是( )
| A.体积比为2:1 | B.分子个数之比为1:l |
| C.原子个数之比为l:1 | D.氮原子个数之比为2:l |
某实验小组只领取下列仪器和用品:铁架台、铁圈、铁夹、三角架、石棉网、烧杯、漏斗、分液漏斗、酒精灯、玻璃棒、量筒、蒸发皿、圆底烧瓶、火柴、滤纸。只用上述仪器和用品,不能进行的实验操作是( )
| A.蒸发 | B.萃取 | C.过滤 | D.蒸馏 |