氢氧燃料电池是一种高效、环境友好的发电装置,它是以铂作电极,KOH溶液作电解液,总反应为:2H2 + O2 = 2H2O,正极反应为:O2 + 2H2O + 4e- = 4OH-下列叙述不正确的是( )
| A.H2通入负极区 | B.O2通入正极区 |
| C.负极发生氧化反应 | D.正极发生氧化反应 |
下列说法正确的是 ( )
| A.淀粉和蛋白质均可作为生产葡萄糖的原料 |
| B.实验室可用酸性高锰酸钾溶液鉴别甲苯和己烯 |
| C.石油裂化和油脂皂化都是高分子生成小分子的过程 |
| D.装饰材料中的甲醛和芳香烃会造成居室污染 |
在一不可变容器中发生如下反应:2NO2 2NO + O2 ΔH >0 达到平衡后,升温,混合气体的()不变
2NO + O2 ΔH >0 达到平衡后,升温,混合气体的()不变
| A.密度 | B.颜色 | C.压强 | D.总物质的量 |
室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是()
| A.溶液中导电粒子的数目减少 |
B.溶液中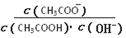 不变 不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10 mL pH=11的NaOH溶液,混合液pH<7 |
在密闭容器中发生反应: aX(g)+bY(g) 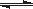 cZ(g)+dW(g)反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,W的浓度为原平衡状态的1.8倍。下列叙述正确的是( )
cZ(g)+dW(g)反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,W的浓度为原平衡状态的1.8倍。下列叙述正确的是( )
| A.平衡向正反应方向移动 | B.(a+b)>(c+d) |
| C.Z的体积分数变大 | D.X的转化率变小 |