(1)A(C4H6O2)的核磁共振氢谱有3种吸收峰,其峰面积之比满足3:2:1,A可与NaHCO3反应放出CO2,则A的结构简式为
(2)已知B(C10H12O)的结构满足以下条件①含有苯环,苯环上有两个取代基;②核磁共振氢谱显示有5种吸收峰③能发生银镜反应。请写出B的结构简式
(3)已知在柑橘、柠檬等水果中含有柠檬酸,且已知柠檬酸中只含C、H、O三种元素。
取柠檬酸19.2 g,在氧气中完全燃烧,产生CO2和H2O分别为26.4 g和7.2 g,现对该物质进行质谱分析,可获得柠檬酸的相对分子质量为192。利用红外光谱分析可知柠檬酸分子中含有—COOH和—OH。请回答:
①通过计算,可获得柠檬酸的分子式为____________。
②再利用核磁共振氢谱分析发现有4个吸收峰,其峰面积之比为4∶2∶1∶1。综合以上信息,写出柠檬酸的结构简式__________________________________。
③柠檬酸与有机物C在一定条件下发生酯化反应可生成一种相对分子质量为220的酯类物质。写出C可能的结构简式________________________________________________________。
二苯基乙二酮常用作医药中间体及紫外线固化剂,可由二苯基羟乙酮氧化制得,反应的化学方程式及装置图(部分装置省略)如下: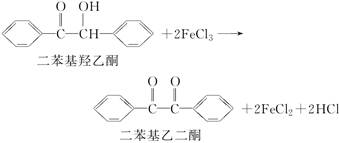
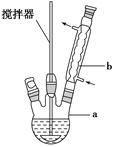
在反应装置中,加入原料及溶剂,搅拌下加热回流。反应结束后加水煮沸,冷却后即有二苯基乙二酮粗产品析出,用70%乙醇水溶液重结晶提纯。重结晶过程:
加热溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥
请回答下列问题:
(1)写出装置图中玻璃仪器的名称:a_________________,b________________。
(2)趁热过滤后,滤液冷却结晶。一般情况下,下列哪些因素有利于得到较大的晶体:________。
A.缓慢冷却溶液 B.溶液浓度较高
C.溶质溶解度较小 D.缓慢蒸发溶剂
如果溶液发生过饱和现象,可采用____________________、____________________等方法促进晶体析出。
(3)抽滤所用的滤纸应略________(填“大于”或“小于”)布氏漏斗内径,将全部小孔盖住。烧杯中的二苯基乙二酮晶体转入布氏漏斗时,杯壁上往往还粘有少量晶体,需选用液体将杯壁上的晶体冲洗下来后转入布氏漏斗,下列液体最合适的是________。
A.无水乙醇 B.饱和NaCl溶液
C.70%乙醇水溶液 D.滤液
(4)上述重结晶过程中的哪一步操作除去了不溶性杂质:________。
(5)某同学采用薄层色谱(原理和操作与纸层析类同)跟踪反应进程,分别在反应开始、回流15 min、30 min、45 min和60 min时,用毛细管取样、点样、薄层色谱展开后的斑点如图所示。该实验条件下比较合适的回流时间是________。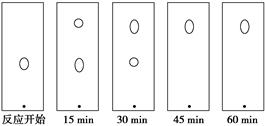
A.15 min B.30 min
C.45 min D.60 min
锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱,但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成[Zn(NH3)4]2+。回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为________(用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式
________________________________________________________________________
________________________________________________________________________。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是________(填序号)。
①硫酸铝和氢氧化钠;②硫酸铝和氨水;③硫酸锌和氢氧化钠;④硫酸锌和氨水。
(4)写出可溶性铝盐与氨水反应的离子方程式______________________________________。试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
铝矾石(主要成分是Al2O3,还含有少量杂质SiO2、Fe2O3)是工业上用于炼铝的主要矿物之一,由铝矾石制取金属铝的工艺流程图如下: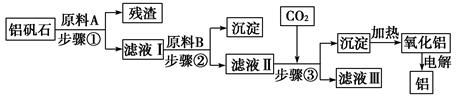
请回答下列有关问题:
(1)下列有关铝矾石以及用铝矾石炼铝的说法中,不正确的是________。
| A.铝矾石中只含有金属氧化物 |
| B.铝矾石与河沙含有相同的成分 |
| C.铝矾石炼铝需要消耗电能 |
| D.铝矾石炼铝的过程中不涉及置换反应 |
(2)原料A的名称是________,步骤①用到的主要玻璃仪器有________。
(3)滤液Ⅰ中要加入稍过量的原料B,原料B的化学式是________,步骤②反应的离子方程式为________________________________________________________________________
________________________________________________________________________。
(4)在步骤③中________(填“能”或“不能”)用盐酸代替CO2,原因是
________________________________________________________________________。
(1)人的胃液呈酸性,其中主要是盐酸,胃酸过多会使身体不适形成疾病,常用胃舒平来治疗,胃舒平主要成分为Al(OH)3,试写出服用胃舒平后,胃中发生的反应:__________________________________________________________________。
沿海渔民也用墨鱼骨(主要成分是CaCO3)治疗胃酸过多,反应的离子方程式为________________________________________________________________________。
(2)在铝制易拉罐中收集满CO2气体,然后向其中倒入10 mL浓NaOH溶液,并迅速用胶带将易拉罐口封住。过一段时间后,罐壁内凹而瘪。再过一段时间后,瘪了的罐壁重新鼓起来(假设易拉罐不会被腐蚀烂)。解释下列变化的实验现象,写出有关化学方程式。
①罐壁内凹而瘪的原因是________________________,反应的化学方程式是
________________________________________________________________________。
②罐重新鼓起的原因是__________________________,化学方程式是
________________________________________________________________________。
(3)铝在人体内积累可使人慢性中毒,1989年世界卫生组织正式将铝定为“食品污染源之一”而加以控制。
铝在下列使用场合须加以控制的是________。
①糖果和食品内包装 ②电线电缆 ③牙膏皮 ④氢氧化铝胶囊(胃舒平,作内服药) ⑤用明矾净水 ⑥用明矾和小苏打混合物作食品膨化剂 ⑦制造炊具和餐具 ⑧制防锈漆
下表是某种常见金属的部分性质:
| 颜色状态 |
硬度 |
密度 |
熔点 |
导电性 |
导热性 |
延展性 |
| 银白色固体 |
较软 |
2.70 g·cm-3 |
660.4℃ |
良好 |
良好 |
良好 |
将该金属投入冷水中无变化,投入稀盐酸中可产生大量的无色气体。试回答:
(1)推断该金属可能的一种用途:
________________________________________________________________________,
该金属的活泼性比铜________(填“强”或“弱”)。
(2)请自选试剂,设计不同的实验,探究该金属与铁的活泼性强弱,并完成下表:
| 猜想 |
验证方法 |
预测实验现象 |
| 该金属活泼性比铁强 |
||
| 该金属活泼性比铁弱 |