工业生产中常将两种或多种金属(或金属与非金属)在同一容器中加热使其熔合,冷凝后得到具有金属特性的熔合物——合金。这是制取合金的常用方法之一。根据下表数据判断,不宜用上述方法制取合金的是( )
| 金属 |
Na |
Al |
Cu |
Fe |
| 熔点(℃) |
97.81 |
660 |
1 083 |
1 535 |
| 沸点(℃) |
883 |
2 200 |
2 595 |
3 000 |
A.Fe-Cu合金 B.Cu-Al合金
C.Al-Na合金 D.Cu-Na合金
下列说法中不正确的有()
①氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂;②光照氯水有气泡逸出,该气体是Cl2;③燃煤时加入适量石灰石,可减少废气中SO2的量;④pH在5.6~7.0之间的降水通常称为酸雨;⑤室温下浓硫酸与铜片不会发生剧烈的化学反应,原因是铜被钝化。⑥氯气易液化,液氯可以保存在钢瓶中;⑦常温下浓硫酸可以用铝制容器盛放;⑧分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤
| A.2个 | B.3个 | C.4个 | D.5个 |
金属铜的提炼多从黄铜矿开始,黄铜矿的熔烧过程主要反应之一为: 2CuFeS2+ O2="" +2FeS+ SO2下列说法正确的是()
2CuFeS2+ O2="" +2FeS+ SO2下列说法正确的是()
| A.CuFeS2仅作还原剂 |
| B.方框中的物质应是CuS |
| C.若有1mol O2参加反应,则反应中有4mol电子转移 |
| D.SO2既是氧化产物,又是还原产物 |
在配制一定物质的量浓度的盐酸溶液时,下列错误操作可使所配制溶液浓度偏高的是()
| A.用量筒量取浓盐酸时俯视读数 | B.溶解搅拌时有液体飞溅 |
| C.定容时俯视容量瓶瓶颈刻度线 | D.摇匀后见液面下降,再加水至刻度线 |
常温时,以下4种溶液pH最小的是()
A.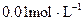 甲酸溶液 甲酸溶液 |
B.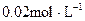 甲酸溶液与 甲酸溶液与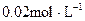 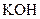 溶液等体积混合后所得的溶液 溶液等体积混合后所得的溶液 |
C.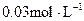 甲酸溶液与 甲酸溶液与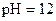 的 的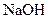 溶液等体积混合后所得的溶液 溶液等体积混合后所得的溶液 |
D.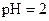 的硫酸与 的硫酸与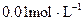 的 的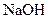 溶液等体积混合后所得的溶液 溶液等体积混合后所得的溶液 |
根据下列反应判断有关物质还原性由强到弱的顺序是()
H2SO3+I2+H2O=2HI+H2SO4 2FeCl3+2HI=2FeCl2+2HCl+I2
3 FeCl2+4H2NO3=2FeCl2+NO+2H2O+Fe(NO3)2
| A.H2SO3> I—>Fe2+>NO | B.I—>Fe2+>H2SO3>NO |
| C.Fe2+>I—>H2SO3>NO | D.NO>Fe2+>H2SO3>I— |