已知:pAg=-lg{c(Ag+)},KspAgCl=1×10-12如图是向10mLAgNO3溶液中逐渐加入0.1 mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线)。根据图象所得下列结论正确的是( )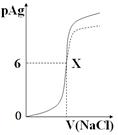
(提示:KspAgCl>KspAgI)
| A.原AgNO3溶液的物质的量浓度为0.1 mol·L-1 |
| B.图中x点的坐标为(100,6 ) |
| C.图中x点表示溶液中Ag+ 与Cl- 浓度相同 |
| D.把0.1 mol·L-1的NaCl换成0.1 mol·L-1NaI则图象在终点后变为虚线部分 |
在一定温度下难溶盐AgCl饱和溶液中,Ag+与Cl-的物质的量浓度类似于水中c (H+)和c (OH-)的关系,即c (Ag+) · c (Cl-)=Ksp(常数)。下列溶液中:①20 mL 0.1 mol·L-1 (NH4)2CO3溶液,②30 mL 0.02 mol·L-1CaCl2溶液,③40 mL 0.03 mol·L-1盐酸,④10 mL H2O,⑤50 mL 0.05 mol·L-1 AgNO3溶液,AgCl的溶解度由大到小的顺序为
| A.①②③④⑤ | B.①④③②⑤ | C.⑤④①②③ | D.④③⑤②① |
今有两种正盐的稀溶液,分别是a mol·L-1NaX溶液和b mol·L-1NaY溶液,下列说法不正确的是
| A.若a=b,pH(NaX)>pH(NaY),则相同浓度时,酸性HX>HY |
| B.若a=b,并测得c(X-)=c(Y-)+c(HY) ,则相同浓度时,酸性HX>HY |
| C.若a>b,测得c(X-)=c(Y-),则可推出溶液中c(HX)>c(HY),且相同浓度时,酸性HX<HY |
| D.若两溶液等体积混合,测得c(X-)+c(Y-)+c(HX)+c(HY)=0.1 mol·L-1,则可推出a+b=0.2 mol·L-1 (忽略两溶液混合时溶液体积的改变) |
在温度相同,压强分别为P1和P2的条件下,A(g)+2B(g) 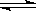 nC(g)的反应体系中,C的百分含量(c%)与时间t的曲线如右图所示,下面结论正确的是
nC(g)的反应体系中,C的百分含量(c%)与时间t的曲线如右图所示,下面结论正确的是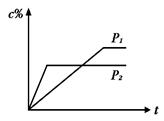
| A.P1>P2,n<3 | B.P1<P2,n>3 |
| C.P1>P2,n>3 | D.P1<P2,n<3 |
已知可逆反应N2O4(g) 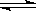 2NO2(g)在873K时,平衡常数K1=1.78×104,转化率为a%,在1273 K时,平衡常数K2 = 2.8×104,转化率为b%,则下列叙述正确的是
2NO2(g)在873K时,平衡常数K1=1.78×104,转化率为a%,在1273 K时,平衡常数K2 = 2.8×104,转化率为b%,则下列叙述正确的是
| A.由于K2>K1,所以a>b |
| B.由于K随温度升高而增大,所以此反应的△H>0 |
| C.由于K随温度升高而增大,所以此反应的△H<0 |
| D.其它条件不变时,将盛有该混合气体的容器置于热水中,体系颜色变浅 |
在一真空密闭容器中,充入10 mol N2和30 mol H2,发生N2+3H2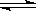 2NH3反应,在一定温度下达到平衡时,H2的转化率为25%。若在同一容器中在相同温度下充入NH3,欲达到平衡时各成分的百分含量与上述平衡相同,则起始时充入NH3的物质的量和达到平衡时NH3的转化率
2NH3反应,在一定温度下达到平衡时,H2的转化率为25%。若在同一容器中在相同温度下充入NH3,欲达到平衡时各成分的百分含量与上述平衡相同,则起始时充入NH3的物质的量和达到平衡时NH3的转化率
| A.15 mol、25% | B.20 mol、50% | C.20 mol、75% | D.40 mol、80% |