从松树中分离得到的松柏醇,其结构简式为, ,它既不溶于水,也不溶于碳酸氢钠溶液,能够跟1mol该化合物起反应的H2或Br2的最大用量分别是( )
,它既不溶于水,也不溶于碳酸氢钠溶液,能够跟1mol该化合物起反应的H2或Br2的最大用量分别是( )
| A.1 mol,2 mol | B.4 mol,2 mol |
| C.4 mol,4 mol | D.4 mol,1 mol |
把下列溶液加水稀释,溶液中每种离子的浓度都不会增加的是
| A.CH3COOH溶液 | B.NaCl溶液 | C.NaOH溶液 | D.FeCl3溶液 |
将下图所示实验装置的K闭合,下列判断正确的是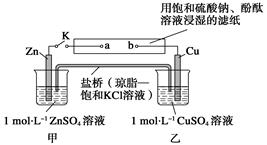
| A.Cu电极上发生氧化反应 | B.电子沿Zn→a→b→Cu路径流动 |
| C.片刻后甲池中c(K+)增大 | D.片刻后可观察到滤纸a点变红色 |
下列热化学方程式中,正确的是
| A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(1) △H=-890.3 kJ·mol-1 |
B.由N2(g)+3H2(g) 2NH3(g) △H=-92.4 kJ·mol-1热化学方程式可知, 当反应中转移6NA电子 时,反应放出的热量小于92.4 kJ 2NH3(g) △H=-92.4 kJ·mol-1热化学方程式可知, 当反应中转移6NA电子 时,反应放出的热量小于92.4 kJ |
| C.HCl和NaOH反应的中和热△H="-57.3" kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol-1 |
| D.在101 kPa时,4gH2完全燃烧生成液态水,放出571.6 kJ热量,氢气燃烧热的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6 kJ·mol-1 |
已知某可逆反应:mA(g)+nB(g) r C(g)在密闭容器中进行。下图表示此反应在不同时间t,温度T和压强p与反应物B在混合气体中的百分含量(B%)的关系曲线。由曲线分析下列判断正确的是
r C(g)在密闭容器中进行。下图表示此反应在不同时间t,温度T和压强p与反应物B在混合气体中的百分含量(B%)的关系曲线。由曲线分析下列判断正确的是
| A.T1>T2,p1>p2,m+n>r,正反应吸热 |
| B.T1<T2,p1<p2,m+n<r,正反应吸热 |
| C.T1>T2,p1>p2,m+n<r,正反应放热 |
| D.T1<T2,p1<p2,m+n>r,正反应放热 |
将4 mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生反应:2A(g)+B(g) 2 C(g),经2s后测得C的浓度为0.6 mol·L-1,下列几种说法中正确的是
2 C(g),经2s后测得C的浓度为0.6 mol·L-1,下列几种说法中正确的是
| A.用物质A表示反应的平均速率为0.3 mol·L-1·s-1 |
| B.用物质B表示反应的平均速率为0.3 mol·L-1·s-1 |
| C.2 s时物质A的转化率为70% |
| D.2 s时物质B的浓度为0.3 mol·L-1 |