请同学们根据官能团的不同对下列有机物进行分类。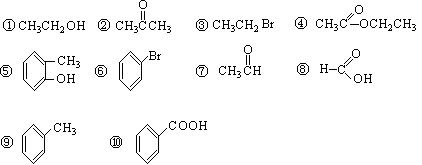
(1)芳香烃: ; (2)卤代烃: ;
(3)醇: ; (4)醛: ;
(5)羧酸: ; (6)酯: 。
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为。
(2)上述反应中的还原剂是,反应产生的气体可用吸收。
(3) As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3—=2H3AsO4+ 3S+10NO2↑+ 2H2O
若生成2mol H3AsO4,则反应中转移电子的物质的量为。若将该反应设计成一原电池,则NO2应该在(填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量(选填编号)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5mol d.无法确定
已知X、Y、Z、W四种元素是元素周期表中连续三个不同短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
(1)X、Y、Z、W四种元素的符号:
X、Y、Z、W
(2)由以上元素中的两种元素组成的能溶于水产生气体且水溶液显碱性的化合物的电子式为。
(3)由X、Y、Z所形成的离子化合物是,它与W的最高氧化物的水化物的稀溶液反应的离子方程式是。
在某一容积为2L的密闭容器内,加入0.8 mol 的H2和0.6 mol 的I2 ;在一定的条件下发生如下反应:H2(g) + I2(g)  2HI(g)ΔH﹤ 0。反应中各物质的浓度随时间变化情况如图1:
2HI(g)ΔH﹤ 0。反应中各物质的浓度随时间变化情况如图1:
(1)根据图1数据,反应开始至达到平衡时,平均速率V(HI)为___________。(精确到小数点后第3位)
(2)反应达到平衡后,第8分钟时,若升高温度, HI浓度的变化正确的是___________(用图2中a~c的编号回答)。
(3)反应达到平衡后,第8分钟时,若加入I2,则H2浓度的变化正确的是___________(用图2中d~f的编号回答)。
(4)反应达到平衡后,第8分钟时,若把容器的容积扩大一倍,请在图中画出从第8分钟开始向后HI浓度的变化情况。
高炉炼铁中发生的基本反应之一如下:
FeO(固)+CO(气)  Fe(固)+CO2(气) △H﹤0。已知1100℃时,K=0.263。化学平衡常数只与温度有关,不随浓度和压强的变化而变化。
Fe(固)+CO2(气) △H﹤0。已知1100℃时,K=0.263。化学平衡常数只与温度有关,不随浓度和压强的变化而变化。
(1)其平衡常数可表示为K=_______,若温度升高,化学平衡移动后达到新的平衡,平衡常数K值_____(本小题空格填写:增大、减小或不变)
(2)1100℃时,测得高炉中c(CO2)="0.025" mol·L-1,c(CO)=0.1mol·L-1,在这种情况下该反应是否处于化学平衡状态_______ (选填“是”或“否”),此时化学反应速率是 υ正___υ逆(选填大于、小于或等于)其原因是___________。
(3)若平衡时,保持容器容积不变,使容器内压强增大,则平衡_______
A. 一定向正反应方向移动 B. 一定向逆反应方向移动
C. 一定不移动 D. 不一定移动
(4)欲提高CO的平衡转化率,可采取的措施()
A. 减少Fe B. 增加FeO
C. 移出部分CO2D. 提高反应的温度
E. 减小容器的体积 F. 加入合适的催化剂
由氢气和氧气反应生成1mol水蒸气放热241.8 kJ,写出该反应的热化学方程式:___ __;若1mol液态水变成气态水时要吸收44kJ的热量,则反应H2(g)+1/2O2(g)=H2O(l)的ΔH ="____" kJ/mol。氢气的燃烧热为____ kJ/mol。