用NA代表阿伏加德罗常数,下列说法正确的是( )
| A.1molO2作为氧化剂得到的电子数一定为4NA |
| B.在标准状况下,11.2L水中含有分子数为0.5NA |
| C.0.4mol/LNa2SO4溶液中,所含Na+和SO42―总数为1.2NA |
| D.标准状况下,40gSO3所占的体积一定小于11.2L。 |
下列哪一组元素的原子间反应容易形成离子键( )。
| 原子 |
a |
b |
c |
d |
e |
f |
g |
| M层电子数 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
①a和c ②a和f ③d和g ④b和g
A.①② B.②④ C.②③ D.③④
下列不是离子化合物的是( )。
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如下图所示。下列说法正确的是( )。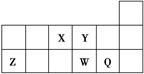
| A.元素X与元素Z的最高正化合价之和的数值等于8 |
| B.原子半径的大小顺序为rX>rY>rZ>rW>rQ |
| C.离子Y2-和Z3+的核外电子数和电子层数都不相同 |
| D.元素W的最高价氧化物对应的水化物酸性比Q的强 |
X、Y、Z是三种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期。X原子的最外层电子数是其电子层数的3倍。Z原子的核外电子数比Y原子少1。下列说法正确的是( )。
| A.元素非金属性由弱到强的顺序为Z<Y<X |
| B.Y元素最高价氧化物对应水化物的化学式可表示为H3YO4 |
| C.三种元素的气态氢化物中,Z的气态氢化物最稳定 |
| D.原子半径由大到小的顺序为Z<Y<X |
运用元素周期律分析下面的推断,其中错误的是( )。
| A.铍(Be)的氧化物的水化物可能具有两性 |
| B.砹(At)为白色固体,HAt不稳定,AgAt感光性很强 |
| C.硫酸锶(SrSO4)是难溶于水的白色固体 |
| D.硒化氢(H2Se)无色、有毒,比H2S更不稳定 |