有 Al2(SO4)3 ,FeSO4,CuCl2, NaOH四种溶液,将其两两反应,若有一种溶液滴入另两种溶液中均产生了白色沉淀,继续滴加该溶液,原白色沉淀或消失或发生颜色变化,则可推断这一种溶液是 ( )
| A.Al2(SO4)3 | B.FeSO4 | C.BaCl2 | D.NaOH |
具有显著抗癌活性的10-羟基喜树碱的结构如图所示。下列关于10-羟基喜树碱的说法正确的是( )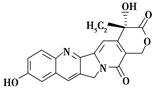
| A.分子式为C20H16N2O5 |
| B.不能与FeCl3溶液发生显色反应 |
| C.不能发生酯化反应 |
| D.一定条件下,1 mol该物质最多可与1 mol NaOH反应 |
某学生用2 mL 1 mol·L-1CuSO4溶液和4 mL 0.5 mol·L-1 NaOH溶液混合,然后加入40%的甲醛溶液 0.5 mL,加热到沸腾,未见砖红色沉淀产生,主要原因是( )
| A.甲醛的量太少 | B.CuSO4的量太少 |
| C.NaOH的量太少 | D.加热时间太短 |
下面说法正确的是( )
| A.含有羟基的化合物一定属于醇类 |
| B.酚和醇都含有羟基,但其化学性质不同 |
| C.分子中含有苯环和羟基的化合物一定是酚 |
| D.Na2SO3、Na2O2、CaO、苯酚久置于空气中,颜色均有变化 |
将两种金属组成的合金溶于盐酸,再滴入足量的NaOH溶液,开始出现白色沉淀且白色沉淀逐渐增多,当NaOH溶液加到一定量时,白色沉淀减少但不完全消失,这种合金是( )
| A.Fe—Al合金 | B.Zn—Al合金 |
| C.Cu—Mg合金 | D.Mg—Al合金 |
对于反应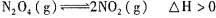 ,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是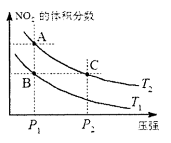
A. 两种不同的温度比较:T1>T2
B. A、C两点的反应速率:A〉C
C. B、C两点的气体的平均相对分子质量:B<C
D. 由状态B到状态A,可以用加热的方法实现