氢化亚铜(CuH)是一种不稳定物质,能在氯气中燃烧;也能与酸反应。用CuSO4溶液和“某物质”在40~50℃时反应可产生它。下列有关叙述中错误的是( )
| A.这“某物质”具有还原性 |
| B.CuH与盐酸反应,可能产生H2 |
| C.CuH与足量的稀硝酸反应:CuH+3H++NO3—=Cu2++NO↑+2H2O |
| D.CuH在氯气中燃烧:CuH+Cl2=CuCl+HCl |
用来表示可逆反应:2A(g)+B(g) 2C(g)△H<0的正确图象是下图中的()
2C(g)△H<0的正确图象是下图中的()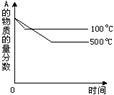

A B C D
下列事实不能用勒夏特列原理(平衡移动原理)解释的是()
①氯化铁溶液加热蒸干最终得不到氯化铁固体;
②铁在潮湿的空气中容易生锈;
③实验室可用排饱和食盐水的方法收集氯气;
④常温下,将1mL pH=3的醋酸溶液加水稀释至100mL,测得其pH<5;
⑤钠与氯化钾共融制备钾Na(1)+KC1(1) K(g)+NaC1(1);
K(g)+NaC1(1);
⑥二氧化氮与四氧化二氮的平衡体系,加压缩小体积后颜色加深
| A.①②③ | B.②⑥ | C.③④⑤ | D.②⑤⑥ |
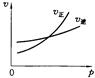
10℃时,某化学反应A→C的反应速率vA=0.1mol·L-1·S-1,若温度每升高10℃,反应速率增加到原来的2倍,若要使vA=1.6 mol·L-1·S-1,则反应温度应控制在()
| A.30℃ | B.40℃ | C.50℃ | D.60℃ |
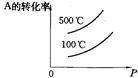
有如下的可逆反应:X(g)+2Y(g) 2Z(g) 现将X和Y以1︰2的体积比混合在密闭容器中,加压到3×107Pa,达到平衡后,已知平衡状态时反应物的总物质的量和生成物的总物质的量相等时,对应图中坐标上的温度是()
2Z(g) 现将X和Y以1︰2的体积比混合在密闭容器中,加压到3×107Pa,达到平衡后,已知平衡状态时反应物的总物质的量和生成物的总物质的量相等时,对应图中坐标上的温度是()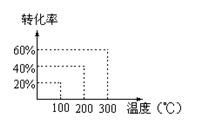
| A.100℃ |
| B.200℃ |
| C.300℃ |
| D.不能确定 |
在一定温度下的定容密闭容器中,当下列物理量不再改变时,不能表明反应:
A(s)+2B(g) C(g)+D(g)已达平衡的是:()
C(g)+D(g)已达平衡的是:()
| A.混合气体的平均摩尔质量 | B.混合气体的密度 |
| C.A物质的质量 | D.气体的总物质的量 |