请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷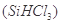 还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
还原法是当前制备高纯硅的主要方法,生产过程示意图如下: 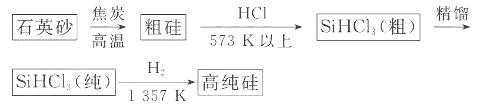
①写出由纯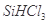 制备高纯硅的化学方程式: ____________________________________。
制备高纯硅的化学方程式: ____________________________________。
②整个制备过程必须严格控制无水无氧。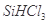 遇水剧烈反应生成
遇水剧烈反应生成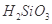 、HCl和另一种物质,配平后的化学反应方程式为___________________________;
、HCl和另一种物质,配平后的化学反应方程式为___________________________;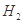 还原
还原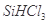 过程中若混入
过程中若混入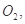 可能引起的后果是____________________________________。
可能引起的后果是____________________________________。
(2)下列有关硅材料的说法正确的是_________ (填字母)。
| A.碳化硅化学性质稳定,可用于生产耐高温水泥 |
| B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承 |
| C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维 |
| D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高 |
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入稀硝酸,振荡。写出实验现象并给予解释 。
在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2IO3-+5SO32-+2H+= I2+5SO42-+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
| 0.01mol·L-1KIO3酸性溶液(含淀粉)的体积/mL |
0.01mol·L-1 Na2SO3溶液的体积/mL |
H2O的体积/mL |
实验温度 /℃ |
溶液出现蓝色时所需时间/s |
|
| 实验1 |
5 |
V1 |
35 |
25 |
t 1 |
| 实验2 |
5 |
5 |
40 |
25 |
t 2 |
| 实验3 |
5 |
5 |
V2 |
0 |
t 3 |
(1) 碘酸钾与亚硫酸钠的反应是 ___________________(填反应类型);
(2)该实验的目的是①____________________________________________,
②_____________________________________________________________;
(3)表中V2="___________mL," V1=___________mL
(4)t1_______ t2_________t3(填“<”、“>”或“=”)
(1)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知: CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.4 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为______________________________;
(2)在体积不变的密闭容器中进行(1)反应,达到平衡后(填“正向移动”、“逆向移动”、“增大”、“减小”或“不变”):
①扩大容器体积,平衡___________,c(H2)____________(与原平衡相比);
②升高温度,正反应速率________ ,逆反应速率___________;
体系的压强__________,平衡___________,平衡常数_____________;
③加入催化剂,H2的物质的量___________________。
( 10分)下列物质:①NaCl固体②无水乙醇③稀硫酸④BaSO4固体⑤冰醋酸⑥H2⑦CO2⑧熔融的KOH(选序号填空)
(1)能导电:_____________(2)非电解质:_____________________
(3)强电解质:_____________(4)弱电解质:____________________
(5)已知25℃时两种酸的电离常数:
Ka(CH3COOH)=1.75×10-5, Ka(HClO)=3.0×10-8
判断该反应是否能发生,若能,完成反应方程式;若不能,无需。
CH3COOH + Ca(ClO)2 ——
(1)淀粉[(C6H10O5)n ]在人体内转化直至最后供给能量的过程可用三个方程式表示,它们依次是:
①__________________________________________________________________。
②___________________________________________________________________。
③__________________________________________________________________。
(2)天然油脂中的烃基一般__________(填“相同”或“不同”),氨基酸、蛋白质分子中都含有两个基团,其中显碱性的是________________,显酸性的是______________,因此,这些物质___________(填下列叙述的序号)
a、只能与HCl反应,不能与NaOH反应
b、只能与NaOH反应,不能与HCl反应
c、既能与HCl反应,又能与NaOH反应
d、既不能与HCl反应,又不能与NaOH反应
这一性质成为物质的___________________(填“酸性”、“碱性”或“两性”)
合成有机玻璃的反应方程式如下: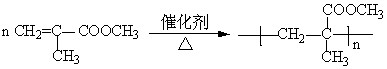
化学反应类型为______________________反应(填“加成聚合”或“缩合聚合”),
其中单体是____________________,高分子化合物的链节为__________________,
n值成为_______________,有机玻璃属于____________(填“纯净物”或“混合物”),原因是_______________________________________________________。