在同温同压下,下列各组热化学方程式中,△H2>△H1的是
| A.S(g)+O2(g)=SO2(g),△H1; S(s)+O2(g)=SO2(g),△H2 |
| B.2H2(g)+O2(g)=2H2O(g),△H1; 2H2(g)+O2(g)=2H2O(l),△H2 |
C.C(s)+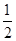 O2(g)=CO(g)△H1;C(s)+O2(g)=CO2(g) △H2 O2(g)=CO(g)△H1;C(s)+O2(g)=CO2(g) △H2 |
| D.H2(g)+Cl2(g)=2HCl(g),△H1; 2H2(g)+2Cl2(g)=4HCl(g),△H2 |
下列说法正确的是
| A.常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为 c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 |
| D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 |
可逆反应N2+3H2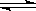 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是
A 3v正(N2)=v正(H2) B v正(N2)=v逆(NH3)
C 2v正(H2)=3v逆(NH3) D v正(N2)=3v逆(H2)
2.0molPCl3和1.0molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:
PCl3(g)+Cl2(g)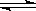 PCl5(g);反应达到平衡时,PCl5为0.4mol;如果此时移走1.0molPCl3 和0.5molCl2,在相同的温度下再达到平衡时,PCl5的物质的量为
PCl5(g);反应达到平衡时,PCl5为0.4mol;如果此时移走1.0molPCl3 和0.5molCl2,在相同的温度下再达到平衡时,PCl5的物质的量为
| A.0.4mol | B.0.2mol | C.小于0.2mol | D.大于0.2mol,小于0.4mol |
在25℃时,分别用pH=9、pH=10的两种氨水中和同浓度、同体积的盐酸,消耗氨水的体积分别为V1和V2,则V1和V2的关系是
| A.V1=10V2 | B.V1>10V2 | C.V1<10V2 | D.V2>10V1 |
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:下列说法错误的是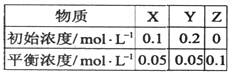

| A.反应达到平衡时,X的转化率为50% |
B.反应可表示为X+3Y 2Z,其平衡常数为1600 2Z,其平衡常数为1600 |
| C.增大压强使平衡向生成Z的方向移动,平衡常数增大 |
| D.改变温度可以改变此反应的平衡常数 |