室温下,向0.1 mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验时不同阶段的溶液,下列有关说法中不正确的是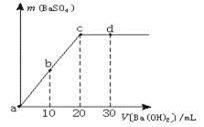
| A.溶液的pH:a<b<c<d |
| B.溶液的导电能力:a>b>d>c |
| C.a、b溶液呈酸性 |
| D.c、d溶液呈碱性 |
常温下,将0.02 mol·L-1的Ba(OH)2溶液100mL和0.02 mol·L-1NaHSO4溶液100mL混合,若忽略溶液体积变化,则混合后的溶液()
| A.pH=12 | B.溶质的物质的量浓度=0.02 mol·L-1 |
| C.pH=2 | D.由水电离的产生的c(H+)=1.0×10-2 mol·L-1 |
把一定浓度的NaOH溶液分成两等份,一份密闭保存,另一份敞口放置,几天后用相同浓度的盐酸去中和它们,至溶液中只有NaCl时,若第一份用去盐酸V1mL,第二份用去盐酸V2mL。则V1和V2的关系正确的是()
| A.V1<V2 | B.V1=V2 | C.V1>V2 | D.不一定 |
为了配制NH4+的浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入适量( )①浓盐酸②NaCl固体③浓氨水④NaOH固体
| A.③ | B.④ | C.①② | D.③④ |
水的电离平衡为H2O  H+﹢OH-,△H>0,下列叙述不正确的是( )
H+﹢OH-,△H>0,下列叙述不正确的是( )
| A.将水加热,pH减小 | B.恒温下,向水中加入少量固体KOH,Kw不变 |
| C.向水中滴入稀醋酸,c(H+)增大 | D.向水中加入少量固体NaClO,平衡逆向移动 |
在密闭容器中,反应X2(g) +Y2(g)  2XY(g);△H < 0,达到平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是.( )
2XY(g);△H < 0,达到平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是.( )
| A.图I是加入适当催化剂的变化情况 | B.图II是扩大容器体积的变化情况 |
| C.图III是增大压强的变化情况 | D.图III是升高温度的变化情况 |