某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化: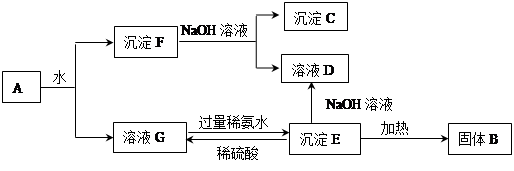
据此回答下列问题:
(1)图中涉及分离溶液与沉淀的方法是__________________。
(2)B、C、D 三种物质的化学式为:B_________ C_________ D_________
(3)沉淀E与稀硫酸反应的离子方程式为________________________________________。
(4)将沉淀F中存在的两种金属元素组成的合金溶于100 mL 4mol/LHCl溶液中,然后再滴加1 mol/L NaOH溶液,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。
已知V1=160mL。根据以上信息回答:
①_________(填“能”或“不能”)计算出V3
②V2为_________mL(若能算出具体数字,请在横线上填写具体数字;若不能请在横线上填“不能确定”)
已知某烃分子中碳元素的质量分数为82.76%,在标准状况下它的密度为2.59g/L。则:
(1)此有机物的相对分子质量为;
(2)此有机物的分子式为;
(3)若该有机物分子结构中含有2个甲基,其结构简式为。
将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如下图的装置:(以下均假设反应过程中溶液体积不变)。
(1)铁片上的电极反应式为。
(2)铜片周围溶液会出现的现象。
(3)若2 min后测得铁片和铜片之间的质量差为1.2g,计算导线中流过的电子的物质的量为mo1。
在化学反应中,反应物转化成生成物,必然发生能量的变化。
(1)下列说法正确的是。
| A.化学变化中的能量变化主要由化学键变化引起的 |
| B.放热反应发生时不一定要加热,但吸热反应必须要加热才能发生 |
| C.钢铁的吸氧腐蚀和析氢腐蚀的负极反应都为Fe—2e一= Fe2+ |
| D.CaCO3(s) =" CaO(s)" + CO2(g) ΔH=" +" 178.5 KJ·mol-1的意义是表示1mol CaCO3完全分解生成1mol CaO和1mol CO2气体要放出178.5 KJ的热量 |
(2)101 kPa条件下,氮气和氢气反应生成氨气的能量变化示意图如下:
已知:①a=1127;②b=1219
则:1molN2和3molH2参与反应生成2molNH3(填“吸收”或“放出”)热量KJ。
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
(1)在以上元素的原子中,原子半径最大的是(填元素符号)。
(2)地壳中含量居于第二位的元素在周期表中的位置是。
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式、。
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是。
| A.最高正化合价为+6价 | B.气态氢化物比H2S稳定 |
| C.最高价氧化物的水化物的酸性比硫酸弱 | D.单质在常温下可与氢气化合 |
(5)由元素⑥、⑧形成的物质X与由元素①、③形成的化合物Y可发生以下反应:
X溶液与Y溶液反应的离子方程式,
M中阳离子的鉴定方法。
按要求完成下列问题:
(1)写出下列反应的化学方程式:
①乙烯通入到溴的四氯化碳溶液中:;
②苯与浓硝酸、浓硫酸混和后加热至50℃ ~60℃ 发生反应:。
(2)苯可以和浓硫酸发生取代反应生成苯磺酸( ),根据质量守恒定律,可判断出另一个反应产物为。
),根据质量守恒定律,可判断出另一个反应产物为。
(3)石蜡油(主要是含17个碳原子以上的液态烷烃混合物)分解实验按照下图进行:
①碎瓷片的作用是。
| A.作反应物 | B.积蓄热量 | C.有催化功能 | D.防止暴沸 |
②将石蜡油分解所得生成物通入到酸性高锰酸钾溶液中,现象是。