T℃时,在1 L的密闭容器中充入2 mol CO2和6 mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H="-49.0" kJ/mol
CH3OH(g)+H2O(g) △H="-49.0" kJ/mol
测得H2和CH3OH(g)的浓度随时间变化情况如下图所示。下列说法不正确的是
A.0~10 min内 (H2)="0.3" mol/(L·min) (H2)="0.3" mol/(L·min) |
| B.T℃时,平衡常数K=1/27,CO2与H2的转化率相等 |
| C.T℃时,反应中当有32 g CH3OH生成时,放出49.0 kJ的热量 |
| D.达到平衡后,升高温度或再充入CO2气体,都可以提高H2的转化率 |
将0.2 mol/L的HX溶液和0.1mol/L的NaOH溶液等体积混合(忽视混合前后溶液体积的变化),下列关系式中一定不正确的是
| A.c(HX) >c(X—) | B.c(Na+)<c(X—) |
| C.c(H+)+c(Na+) = c(OH—)+c(X—) | D.c(HX)+c(X—)="0.2" mol/L |
25℃时,水的电离达到平衡状态:H2O H++OH-,下列叙述正确的是
H++OH-,下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| C.向水中加入少量金属钠,平衡逆向移动,c(H+)降低 |
| D.向水中加入CH3COONa,平衡逆向移动,c(H+)降低 |
某反应的△H= +100kJ/mol,下列有关该反应的叙述正确的是
| A.正反应活化能小于100 kJ/mol |
| B.逆反应活化能一定小于100 kJ/mol |
| C.正反应活化能不小于100 kJ/mol |
| D.正反应活化能比逆反应活化能大100 kJ/mol |
α1和α2分别为A、B在两个恒容容器中平衡体系A(g) 2B(g)和2A(g)
2B(g)和2A(g) B(g)的A的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是
B(g)的A的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是
A.α1、α2均减小 B.α1、α2均增大
C.α1减小,α2增大 D.α1增大,α2减小
在密闭容器发生下列反应aA(g) 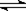 cC(g) + dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g) + dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
| A.A的转化率变大 | B.C的浓度减小 |
| C.D的体积分数变大 | D.a < c+d |