“酸化”是实验中经常采用的方法,下列酸化过程正确的是
| A.抑制Fe2+的水解,用稀硝酸酸化 |
| B.提高高锰酸钾的氧化能力,用盐酸酸化 |
C.确认溶液中含有 时,先用盐酸酸化,再检验 时,先用盐酸酸化,再检验 |
| D.检验氯乙烷中的氯元素,加碱溶液加热后,用稀硫酸酸化后,再检验 |
有关化学用语的表示正确的是
| A.HCN分子的结构式:H—C ≡ N | B.二氧化碳的电子式: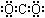 |
C.Cl—的结构示意图为:  |
D.乙烯的结构简式为CH2CH2 |
设NA为阿伏伽德罗常数的数值,则下列说法中不正确的是
①2.24L氖气含有NA个电子,② 18gD2O中所含的中子数为10NA,③标准状况下,11.2LSO3含有的分子数为0.5NA,④ 过氧化钠与水反应,若电子转移2NA,则产生的氧气为32 g,⑤在1L 0.1mol/L的碳酸钠溶液中,CO32-总数小于0.1NA
| A.①②③⑤ | B.①④⑤ | C.①②③ | D.②③⑤ |
下列变化需克服相同类型作用力的是
| A.硅和C60的熔化 | B.碘和干冰的升华 |
| C.氯化氢和氯化钾的溶解 | D.溴和汞的气化 |
下列金属防腐的措施中,使用外加电流的阴极保护法的是
| A.水中的钢闸门连接电源的负极 | B.金属护拦表面涂漆 |
| C.汽水底盘喷涂高分子膜 | D.地下钢管连接镁块 |
根据所学的化学知识判断下列说法正确的是
| A.碘是人体必需微量元素,所以要多吃富含碘单质的食物 |
| B.福岛核电站泄露的放射性物质131I与127I所有性质完全相同 |
| C.晶体硅用于生产光导纤维 |
| D.使用清洁能源是防止酸雨发生的重要措施之一 |