A、B、C、D、E、F、G都是链状有机物,它们的转化关系如图所示。A只含一种官能团,D的相对分子质量与E相差42,D的核磁共振氢谱图上有3个峰,且峰面积之比为1:3:6,请回答下列问题:
已知:Mr(R-Cl)-Mr(ROH)=18.5, Mr(RCH2OH)-Mr(RCHO)=2, Mr表示相对分子质量。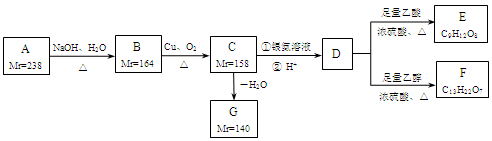
(1)A中含有的官能团是______。
(2)写出D的分子式______。
(3)下列有关A~G的说法正确的是______。
a.每个A分子中含有官能团的数目为4个
b.B中所有官能团均发生反应生成C
c.C生成G只有1种产物
d.G存在顺反异构现象
(4)写出B生成C的化学方程式______。
(5)芳香族化合物H与G互为同分异构体,1mol H与足量氢氧化钠溶液反应消耗2mol NaOH,且H苯环上的一氯代物只有两种,写出其中任意一个符合条件的H的结构简式______。
(6)E与足量NaOH溶液共热,此反应的化学方程式为______。
(8分)(2010·北京卷)镇痉药物C、化合物N以及高分子树脂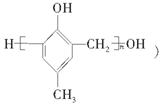 的合成路线如下:
的合成路线如下: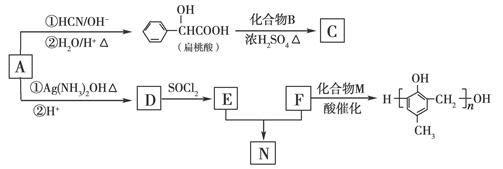
已知:
RCHO①HCN/OH-②H2O/H+△
RCOOH RCOOR′ (R、R′代表烃基)
RCOOR′ (R、R′代表烃基)
(1)A的含氧官能团的名称是________。
(2)A在催化剂作用下可与H2反应生成B。该反应的反应类型是________。
(3)酯类化合物C的分子式是C15H14O3,其结构简式是________。
(4)A发生银镜反应的化学方程式是
________________________________________________________________________。
(5)扁桃酸(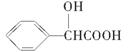 )有多种同分异构体。属于甲酸酯且含酚羟基的同分异构体共有________种,写出基中一种含亚甲基(-CH2-)的同分异构体的结构简式________。
)有多种同分异构体。属于甲酸酯且含酚羟基的同分异构体共有________种,写出基中一种含亚甲基(-CH2-)的同分异构体的结构简式________。
(6)F与M合成高分子树脂的化学方程式是________。
(7)N在NaOH溶液中发生水解反应的化学方程式是________。
(8分)(2010·山东卷)利用从冬青中提取的有机物A合成抗结肠炎药物Y及其他化学品,合成路线如下: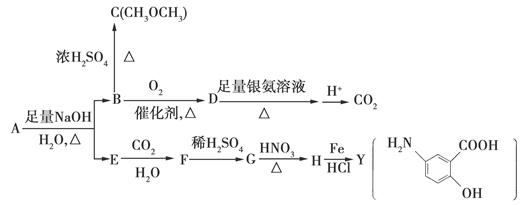
提示: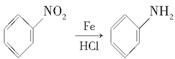
根据上述信息回答:
(1)D不与NaHCO3溶液反应,D中官能团的名称是________,B→C的反应类型是________。
(2)写出A生成B和E的化学反应方程式________。
(3)A的同分异构体I和J是重要的医药中间体,在浓硫酸的作用下I和J分别生成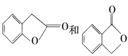 ,鉴别I和J的试剂为________。
,鉴别I和J的试剂为________。
(4)A的另一种同分异构体K用于合成高分子材料,K可由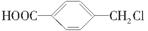 制得,写出K在浓硫酸作用下生成的聚合物的结构简式________。
制得,写出K在浓硫酸作用下生成的聚合物的结构简式________。
(8分)(2011·苏北四市调研)乙基香兰素是当今世界上最重要的合成香料之一,其结构简式如下所示。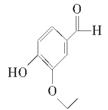
(1)以下推测正确的是________(填字母)。
a.从分子结构上看,它应该属于芳香烃
b.该物质的一个分子内含有一个碳氧双键、三个碳碳双键
c.1 mol该物质最多能与4 mol H2发生加成反应
d.该物质能与碳酸钠溶液反应产生CO2气体
(2)R物质属于乙基香兰素的同分异构体,其性质如下:
试写出符合条件的R的同分异构体的结构简式(任写两种):________、________。
(3)X也是乙基香兰素的同分异构体,可以通过不同的反应制得下列物质。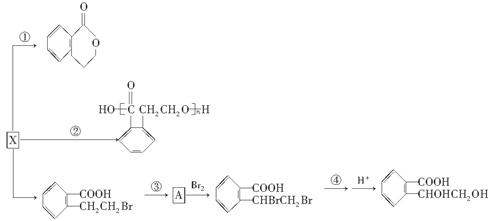
请回答下列问题:
(Ⅰ)反应①、②的反应类型________、________;
(Ⅱ)反应③所需的试剂是________________;A的结构简式________;
(Ⅲ)反应④的化学方程式____________________________________________________。
(8分)聚氯乙烯(PVC)保鲜膜的安全问题引起广泛的关注。PVC的安全隐患主要来自于塑料中残留的PVC单体以及不符合国家标准的增塑剂DEHA。工业上用乙烯和氯气为原料经下列各步合成PVC:乙烯一定条件①甲一定条件②乙一定条件③PVC
(1)乙是PVC的单体,其结构简式为__________________________________________;
(2)反应③的化学方程式为__________________________________________________;
(3)写出以下反应类型:
反应①__________________;反应②________________。
(4)邻苯二甲酸辛酯(DOP)是国家标准中允许使用的增塑剂之一,邻苯二甲酸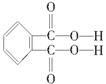 是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂DMP(分子式为C10H10O4),DMP属于芳香酯,其结构简式为
是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂DMP(分子式为C10H10O4),DMP属于芳香酯,其结构简式为
______________________________________。
(5)聚甲基丙烯酸羟乙酯的结构简式为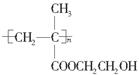 ,它是制作软质隐形眼镜的材料。请写出下列有关反应的化学方程式:
,它是制作软质隐形眼镜的材料。请写出下列有关反应的化学方程式:
①由甲基丙烯酸羟乙酯制备聚甲基丙烯酸羟乙酯______________________________;
②由甲基丙烯酸制备甲基丙烯酸羟乙酯______________________________________;
③由乙烯制备乙二醇___________________________________________________。
(8分)某酿造厂以淀粉为主要原料,制取葡萄糖、酒精和醋酸,并且醋酸和异丁醇[(CH3)2CHCH2OH]反应制取乙酸异丁酯。乙酸异丁酯主要用于配制香蕉、草莓和奶油等香型的香精。其反应过程如下:
淀粉①葡萄糖②乙醇③乙醛④乙酸⑤乙酸异丁酯
回答下列问题:
(1)写出下列反应的化学方程式:
①________________________________________________________________________;
②________________________________________________________________________;
⑤________________________________________________________________________。
(2)葡萄糖是一种重要的营养物质,它是人类生命活动所需能源的重要来源之一。已知葡萄糖的燃烧热是2840 kJ·mol-1,写出葡萄糖完全氧化的热化学方程式:
________________________________________________________________________。