A~F均为元素周期表中前四周期元素,其相关信息如下表:
| 元素 |
相 关 信 息 |
| A |
A的基态原子最外层电子排布式为2s22p3 |
| B |
B是地壳中含量最高的元素 |
| C |
C+与B的简单离子的电子层结构相同 |
| D |
D的一种核素的质量数为64,中子数为35 |
| E 、F |
E 、F既同周期又同族,且原子序数F比E多2 |
请回答下列问题:
(1)D的价电子的电子排布式是 ;F原子的原子结构示意图为 。
(2)A、B的第一电离能的大小顺序为 。
(3)AB3-中A原子的杂化轨道类型为_______;与A2B互为等电子体的分子的分子式为 (任写一个即可)。
(4)D晶体的晶胞如图所示为面心立方最密堆积 (在晶胞 的顶点和面心均含有一个D原子)。则D的晶体中D原子的配位数为 。
(5)已知17gA的简单氢化物催化氧化生成气态水时放出QkJ的热量,请写出A的简单氢化物催化氧化的热化学反应方程式 。
(6)C2B2的电子式为____;它可与E的二氯化物溶液反应,若反应的C2B2与E的二氯化物的物质的量之比为1:2,则该反应的化学反应方程式为 。
下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空
回答以下问题:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 二 |
① |
② |
||||||
| 三 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
||
| 四 |
⑨ |
⑩ |
(1)在这些元素中,金属性最强的元素是 ,最活泼的非金属元素是 ;
(2)化学性质最不活泼的元素是 ,其原子的原子结构示意图为 ;
(3)元素的最高价氧化物对应的水化物中酸性最强的是,碱性最强的是 ,呈两性的氢氧化物是;
(4)在③~⑦元素中,原子半径最大的是;
(5)在⑦与⑩的单质中,化学性质较活泼的是,可用什么化学反应说明该事实(写出反应的化学方程式):。
(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+ 4 NO2 (g)= 4 NO(g)+ CO2 (g)+ 2 H2O(g)ΔH= -574 kJ · mol-1
CH4(g)+ 4 NO(g)= 2 N2(g)+ CO2 (g)+ 2 H2O(g)ΔH= -1160 kJ· mol-1
(1)若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总数为
(阿伏加德罗常数的值用NA表示),放出的热量为kJ。
(2)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式_______________________________。
(3)甲硅烷(SiH4)是一种无色液体,遇到空气能发生爆炸性自燃,生成(SiO2)和水。已知室
温下10 g甲硅烷自燃放出热量446 kJ,表示其燃烧热的热化学方程式为:
________________________________________________________________________。
(4)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2是放热反应,当1 mol Cl2参与反应时释放145 kJ的热量,写出这个反应的热化学方程式:
_________________________________________________________________________。
请根据反应:Cu + 2FeCl3 = CuCl2 + 2FeCl2,设计一个原电池。
(1)画出装置图,标明两极材料和电解质溶液,并指出正、负极。
(2)写出两电极上的电极反应式。
2SO2(g)+O2(g)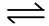 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。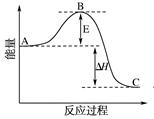
已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。
请回答下列问题:
图中A、C分别表示________________、________________,
E的大小对该反应的反应热有无影响?______________。
(2)图中ΔH=____________ kJ·mol-1;
(3) 反应速率v(SO2)为0.05 mol · L-1 · min-1,则v(O2)=____________mol · L-1 · min-1、
v(SO3)=____________mol · L-1 · min-1;
(4) 已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3 mol SO3(g)的ΔH=________。
下列物质:①N2 ②Na2O③NH3④CO2⑤Na2O2
⑥NaOH⑦CaBr2⑧H2O2⑨NH4Cl⑩HBr。
回答下列问题:(填序号)
(1)只含离子键的是;(2)只含极性键的是;
(3)含有极性键和非极性键的是;(4)含有非极性键的离子化合物是;
(5)含有极性键的离子化合物是。