化学课后,化学兴趣小组的同学在整理实验桌时,发现有一瓶氢氧化钠溶液没有塞橡皮塞,征得老师同意后,开展了以下探究:
[提出问题1]该氢氧化钠溶液是否变质了呢?
[实验探究1]
| 实验操作 |
实验现象 |
实验结论 |
| 取少量该溶液于试管中,向溶液中滴加稀盐酸,并不断振荡. |
有气泡冒出. |
氢氧化钠溶液一定变质了. |
[提出问题2]该氢氧化钠溶液是全部变质还是部分变质呢?
[猜想与假设]
猜想1:氢氧化钠溶液部分变质.
猜想2:氢氧化钠溶液全部变质.
[查阅资料]
(1)氯化钙溶液呈中性.
(2)氯化钙溶液能与碳酸钠溶液反应:CaCl2+Na2CO3=CaCO3↓+2NaCl
[实验探究2]
| 实验步骤 |
实验现象 |
实验结论 |
| (1)取少量该溶液于试管中,向溶液中滴加过量的氯化钙溶液,并不断振荡. |
有 生成. |
说明原溶液中一定有碳酸钠. |
| (2)取步骤(1)试管中的少量上层清液,滴加酚酞溶液. |
溶液变红色. |
说明原溶液中一定有 . |
[实验结论]该氢氧化钠溶液 (填“部分”或“全部”)变质.
[反思与评价]
(1)氢氧化钠溶液露置于空气中容易变质,请写出相关反应的化学方程式: .
(2)在上述[实验探究2]中,小明提出可用氢氧化钙溶液代替氯化钙溶液,你认为该方案 (填“可行”或“不可行”).
[理解与应用]
氢氧化钠溶液容易变质,必须密封保存.实验室必须密封保存的药品还有很多,试另举一例: .
(6分)2014中考化学实验操作考试其有的四个考题是:
①配制一定溶质质量分数的溶液
②葡萄糖的检验
③二氧化碳的制取、收集和验满④氧气的制取、收集和验满。
考试的方法是由考生抽签确定考题,小凯同学抽签后被监考老师引导至准备了下列仪器和药品的实验台前:
请回答:
(1)由实验台上提供的仪器和药品,你认为小凯抽到的是第个考题;
(2)若增加(填一种玻璃仪器名称),还能组装成高锰酸钾制氧气的发生装置,氧气的验满方法是。
(3)若以H2O2溶液为原料(以MnO2为催化剂)在实验室中制备干燥的氧气。并用来测定CuO和Cu的混合物样品中CuO的含量,如图所示,仪器的连接顺序为:A→B→C。
①仪器B的作用是。
②仪器A中生成氧气的化学方程式是。
③欲通过测量反应前、后C处大玻璃管质量的增加,来计算样品中CuO的含量。若反应欲通过测量反应前、后大玻璃管中红色的Cu还没有完全消失,则样品中CuO含量的测算结果将(填“偏小”“偏大”“不受影响”之一)。
(5分)某兴趣小组话动中,同学们按图1装置对“可燃物燃烧的条件”进行探究。探究过程中,发现白磷燃烧产生大量白烟,会刺激人体呼吸道,可能与空气中水蒸气反应,生成有毒的偏磷酸(HPO3)。已知白磷的着火点是40℃,红磷的着火点是240℃,请回答
(1)同学们对图1装置进行改进,按改进后的图2装置进行实验,改进后的装置优点是,不足是。
(2)请你帮助他们将下表补充完整。
| 现象 |
解释 |
| a试管中白磷燃烧,热水中白磷没有燃烧. b试管中红磷没有燃烧. |
b试管中红磷、热水中白磷都没有燃烧的原因是①; ②。 |
(3)能说明空气是混合物的实验现象为:实验结束后,图2装置保持原样。待a试管冷却后,如果将试管口紧贴水面(室温下)。热水中的白磷没有与氧气(或空气)接触。
小红同学想探究实验室中碳酸钙和盐酸制取二氧化碳后废液中溶质的成分,
请你一同参与探究并回答。
【提出问题】废液中的溶质是什么物质?
【作出猜想】小红认为废液中溶质只有CaCl2。
你认为废液中含有的溶质是(填化学式)。
【查阅资料】CaCl2溶液呈中性。
【实验与结论】
(1)请你写出碳酸钙和盐酸反应的化学方程式。
(2)分别取少量该废液和CaCl2溶液加入到两支试管中,并向其中分别滴入无色酚酞试液做对比试验,结果两支试管中溶液均无色,于是小红认为自己的猜想是正确的。
(3)你认为小红的实验(填“能”或“不能”)证明她的猜想。
(4)如果要证明你的猜想是正确的,你选择。(填字母:A、石蕊试液 B、氢氧化钠溶液 C、稀盐酸)来代替酚酞试液。现象是。
(5)为了防止这种废液造成环境污染,可以在废液中加入过量的充分反应后过滤,废液中就只剩一种溶质了。
实验室有几瓶未知浓度的氢氧化钠溶液,某兴趣小组同学欲用1%的稀盐酸来测定其溶质的质量分数。以下是几组同学的设想和做法:
(1)甲组同学的实验如下图所示:在烧杯中加入5g氢氧化钠溶液,滴入几滴酚酞溶液,用滴管慢慢滴入1%的稀盐酸,并不断搅拌,至溶液颜色恰好变为无色为止。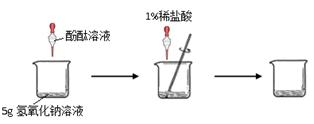
请回答:
①酚酞溶液的作用是;
②氢氧化钠与盐酸反应的化学方程式为;
③当溶液颜色恰好变为无色时,共用去了稀盐酸7.3g,试求甲组这瓶氢氧化钠溶液中溶质的质量分数和反应后所得溶液中溶质的质量分数(写出计算过程,结果用百分数表示)。
(2)乙组同学的设想是:在烧杯中加入一定量的氢氧化钠溶液,用滴管慢慢滴入1%的稀盐酸,并不断搅拌,通过用pH试纸多次测定溶液pH的办法,达到实验目的。
①下列使用pH试纸的方法正确的是(填字母)。
| A.将pH试纸剪成几段节约使用 |
| B.将pH试纸直接插入待测液中 |
| C.将pH试纸放在干净的白瓷板上,用玻璃棒蘸取待测液滴在pH试纸上 |
| D.将pH试纸用蒸馏水润湿后放在玻璃片上,用玻璃棒蘸取待测液滴在pH试纸上 |
②由于用pH试纸需多次测定,较繁琐,且所测数值不够精确。在老师指导下,乙组同学取了5g氢氧化钠溶液进行了数字化实验,由计算机描绘出了整个实验过程中溶液pH的变化图像(简单表示为下图)。
请回答:图中a点表示的含义是;b点溶液中的溶质有(填化学式);乙组同学要计算出本组这瓶氢氧化钠溶液中溶质的质量分数,除了要用到已有数据外,你认为还需要的数据是。
(3)丙组同学在滴加稀盐酸一段时间后,发现溶液中有少量气泡产生。这一“异常现象”激起了他们的探究欲望,通过实验证明:该组用的这瓶氢氧化钠溶液已经部分变质。请用化学方程式表示其变质的原因;
实验室有一瓶长期暴露在空气中的氢氧化钠固体,某兴趣小组的同学对该样品的成分及含量进行了探究。
【实验探究一】为得到纯净的氢氧化钠固体,并测定NaOH的纯度,设计的实验过程如下图。请回答下列问题: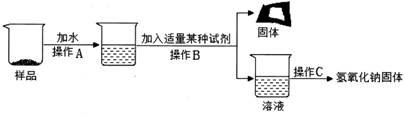
①长期暴露在空气中的氢氧化钠固体样品,所含杂质是(1),操作B中加入的试剂是(2);(以上填写化学式或物质名称均可)
②操作A、B 的名称分别为(3)、(4);
③若要测定该固体中NaOH的纯度,实验过程中一定还需用到的仪器是(5)。
【实验探究二】为了测定NaOH的纯度,小红同学设计如图装置(铁架台略去)。己知,碳酸氢钠溶液不吸收二氧化碳。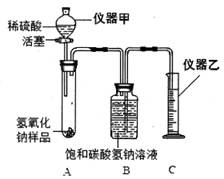
④写出指定仪器的名称:
甲(6)、乙(7);
⑤实验中取用样品质量要控制在一定范围内,如果样品用量过多,造成的后果是(8);
⑥取l0g样品进行实验,根据实验数据,通过计算可知产生了CO2 0.11g ,求原样品中NaOH的纯度,写出计算过程。
(9)【实验反思】
⑦利用该实验装置,若操作正确,装置气密性良好,测定的NaOH纯度也将(10)(填“偏大”或“偏小”),理由是(11)。