某兴趣小组同学对废干电池筒内黑色固体进行探究.
查找资料得知:
①废干电池内含有Mn02、NH4Cl、ZnCl2等;
②NH4Cl具有铵态氮肥的性质;
③向ZnCl2溶液中逐滴滴入稀氨水,先生成Zn(OH)2白色沉淀,然后沉淀溶解,生成可溶性的
[Zn(NH3)4]Cl2.
据此,该兴趣小组同学进行了如下探究:
(1)检验Mn02的存在.兴趣小组同学设计了如图所示的实验: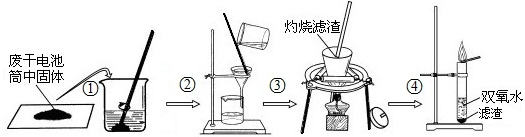
操作②的名称是 ,该操作中玻璃棒的作用是 .
操作③灼烧黑色滤渣时,会产生一种能使澄清石灰水变浑浊的气体,该气体为 .
操作④的试管中产生的气体能使带火星的木条复燃,该气体为 .
由此得出结论:滤渣中除含有 外,还含有黑色粉末 .
(2)猜想1:滤液中溶质的主要成分为NH4Cl.
操作:取少量滤液加入盛有NaOH固体的试管,并加热.未闻到明显的刺激性气味,但用紫色石蕊试纸放在试管口一段时间,试纸变蓝色.
实验结论:该滤液中含有少量的NH4Cl.
(3)猜想2:滤液中溶质的主要成分为ZnCl2.向盛有少量滤液的试管中逐滴加入 ,观察到 .
实验结论:滤液中溶质的主要成分是ZnCl2.
某化学课堂围绕"酸碱中和反应",将学生分成若干小组,在老师引导下开展探究活动。以下是教学片段,请你参与学习并帮助填写空格(包括表中空格)。
【演示实验】将一定量的稀
加入到盛有
溶液的小烧杯中。
【学生板演】该反应的化学方程式。
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】针对疑问,太家纷纷提出猜想。甲组同学的猜想如下:
猜想一:只有
猜想二:有 和
猜想三:有 和
猜想四:有 、 和
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的。不合理的猜想是
【实验探究】(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴
溶液,无明显变化,溶液中一定没有。
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的
试纸、铜片、
溶液、
溶液,进行如下三个方案的探究。
| 实验方案 | 测溶液 | 滴加 溶液 | 滴加 溶液 |
| 实验操作 |  |
 |
 |
| 实验现象 | 试纸变色,对比比色卡, <7 | 产生白色沉淀 | |
| 实验结论 | 溶液中有 | 溶液中有 | 溶液中有 |
【得出结论】通过探究,全班同学一致确定猜想二是正确的。
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定。
【实验探究】同时指出(2)中存在两处明显错误,请大家反思。同学们经过反思发现了这两处错误:
(1)实验操作中的错误是。
(2)实验方案中也有一个是错误的,错误的原因是。
下图为某学习小组探究金属化学性质时所做的四个实验,仔细分析后回答下列问题:
(1)描述
中的实验现象.
(2)写出 中反应的化学方程式.
(3)要证明
的活动性顺序,至少要做的实验是(填序号).
(4)开始反应后
中溶液逐渐变为黄色,原因是.
(8分)在浓硫酸的催化作用下,固体草酸(
)受热分解生成碳的氧化物和水。
某化学课外兴趣小组对碳的氧化物的成分进行了实验探究。
【提出问题】如何通过实验确定碳的氧化物的成分。
【猜想】
| 猜想1 |
猜想2 |
猜想3 |
| 只有 | 只有 |
和
都有 |
【设计实验】基于猜想3,兴趣小组同学设计了如下实验装置:
【实验探究】
(1) 实验过程中观察到装置(填字母)中的澄清石灰水变浑浊,证明有
气体。
(2) 实验过程中还观察到以下实验现象:①
装置中澄清石灰水不变浑浊;②
装置中黑色粉末变成红色;③,证明有
气体。
【实验结论】通过实验探究证明:猜想3成立
草酸分解的化学方程式是。
【问题讨论】
(1)
装置的作用是;
装置的作用是。
(2) 装置末端酒精灯的作用是。
科学研究小组的同学在用一定浓度的硫酸溶液处理废金属材料(主要是生铁、镀锌铁皮)时,溶液发烫并闻到了刺激性气味,这种反常现象引起了同学们的思考.从组成物质的元素角度分析,他们猜测气体可能是
中的一种或几种.为了确定该气体的成分,他们进行了如下探究.
查阅资料:
I.
都能与碱溶液反应生成盐和水,
难溶于水;
II.
能与酸性高锰酸钾溶液反应并使它褪色,上述其它气体不能.
实验探究:
(1)甲同学为了验证处理废金属材料产生的气体中是否含有
,把它直接通入澄清石灰水,并观察实验现象.
乙同学认为甲同学的做法不合理.请用化学方程式表示其原因.
(2)同学们设计了一套合理的实验装置,如下图所示(铁架台已略去).请你从下列试剂中选择所需药品并完成实验(药品可重复选用):澄清石灰水,氢氧化钠溶液,酸性高锰酸钾溶液,浓硫酸,无水硫酸铜,碱石灰(假设每步反应都是完全的).
①写出
装置中试剂的名称或化学式.
②若观察到(填装置序号)中澄清石灰水变浑浊,证明原气体中有 ;
③若观察到现象,证明原气体中有 无 .
如图是八年级下册研究性学习课题《化学反应中质量守恒的研究》的实验装置.本实验通过测定氧化汞分解前后反应物和生成物的质量是否相等来验证质量守恒定律.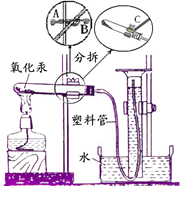
已知:氧化汞分解的反应方程式:
请回答下列问题:
(1)在组装实验装置时,欲调整试管的倾斜度,应调节图中
哪个旋钮?.
(2)下列有关本实验的描述正确的有哪些?.
A.在量筒中加入一些煤油,可以减少氧气在水中的溶解
B.塑料管口放出连续均匀的气泡后才能收集气体
C.氧化汞未分解完全就停止加热对实验结果没有影响