(1)在工农业生产和日常生活中,化学物质具有广泛的用途.
请用下列物质的化学式选择填空:氦气、氮气、氧化钙、盐酸、硝酸、硫酸亚铁.
①可用来替代氢气作为探空气球的稀有气体是 .
②可用于生产炸药、染料,与金属反应一般不产生氢气的酸是 .
③可用于治疗缺铁性贫血的药物是 .
④为了防止某些食品受潮,在其包装袋中放入一小袋干燥剂.这种干燥剂是 .
(2)利用化学知识,还可以防止生活中一些不利现象的产生:
①为保证人身体安全,进入久未开启的菜窖前,须做到 试验;
②为防止照片褪色,可将照片塑封(用塑料薄膜封闭),目的是隔绝 ;
③2005年哈尔滨发生严重的水污染事件,有关部门利用大量活性炭使水净化,这是利用了活性炭的 性;
④为延长食品保质期,有些食品袋内放有一包“双吸剂”(主要成分是活性铁粉),这里“双吸剂”所吸收的两种物质指的是: .
(3)松花蛋又名皮蛋.松花蛋的制作工艺一般是用水将灰料[主要是生石灰(CaO)、草木灰(成分中含K2CO3)、纯碱(Na2CO3)、食盐(NaCl)等]调成糊状,涂于新鲜鸭蛋,密封保存一段时间后,即可得到松花蛋.请根据以上信息回答:
①松花蛋腌制中发生的化学反应有 个;
②剥除松花蛋外边灰料后,常常发现蛋壳上有一些坚硬的白色斑点,这斑点的主要成分是 ;
③食用劣质松花蛋时往往有麻涩感,可能的原因是 .
(4)一些重要的营养素如:糖类、淀粉、油脂、蛋白质、维生素等,对人类的生命活动具有重要意义.作为处在身体生长发育关键时期的中学生,不能偏食、挑食,每天都要摄入足够、均衡的营养.
①某同学平时不吃饭,只吃菜,结果出现乏力、疲倦甚至昏迷等症状,他缺少的营养素是 ;
②某同学在毕业体检时,检查出蛋白质摄入量不足.假如你是一名医生,你会建议他在平时的饮食中应该多吃的食物是 (任填一种).
请根据下列事实写出化学方程式。
(1)实验室用锌粒制取氢气:。
(2)用红磷除去氮气中少量的氧气:。
请你根据所学的化学知识,用化学符号填空。
(1)按体积计算,空气中含量最多的气体是。
(2)干冰的主要成分是 。
(3)金属活动性顺序里,活动性最强的金属是。
(4)铁丝在氧气中燃烧后的产物。
在点燃条件下,A和B反应生成C和D。反应前后分子变化的微观示意图如图所示。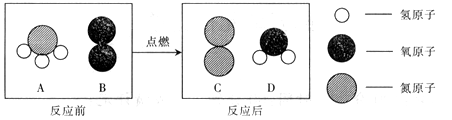
请回答下列问题:
(1)该反应的化学方程式为。
(2)分析微观示意图,你能获得的信息还有(各写一条)
宏观方面。
微观方面。
工人师傅在切割钢板时,常用硫酸铜溶液来划线,划过的地方出现一道红色的线,你知道其中的原理吗?请用化学方程式表示
该反应的基本类型是。
为了减少汽车尾气对空气的污染,目前部分汽车已使用天然气代替汽油作燃料,以减少对空气的污染。
(1)写出天然气燃烧的化学方程式 。
(2)天然气的主要成分若是出现在煤矿井里,达到一定浓度,遇明火就会发生爆炸,为了防止瓦斯爆炸,煤矿的矿井里必须采取、。