周期表中前36号元素A、B、C、D、E、F、G、H,它们的原子序数依次增大,其中B、C、D为同一周期;E、F、G为同一周期;A和E、D和G分别为同一主族;A与B组成的化合物是一种温室气体;D元素原子的最外层电子数是次外层电子数的3倍;E是所在周期原子半径最大的元素(除稀有气体外);F元素的离子半径是同周期元素形成的简单离子中最小的;H元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。
(1)E2D2物质中化学键的类型是__________________
(2)一定条件下,A2气体与C2气体充分反应可生成6.8 g的气体,放出18.44 kJ热量,则该反应的热化学方程式为:_________________________________________;生成物分子的空间构型为_________________,其中C的杂化方式为_______________。
(3)C和E组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是
。
(4)H的基态原子的电子排布式为__________________________已知H2+能与(2)中的生成物的水溶液形成配合物,请写出该配合物中阳离子的结构简式:_________________,在此配合物的水溶液中加入乙醇,现象是_______________________________________。
(5)将足量的GD2通入EDA溶液中所得溶液的离子浓度的大小顺序为:
铝是生活中非常常见的一种金属,运用所学知识回答:
(1)金属铝是活泼的金属,可在生活中应用很广泛,原因是。
(2)铝盐或铁盐能用于净水,是因为铝盐或铁盐在水溶液中形成了。
(3)在一个瘪了的铝制易拉罐加入适量的NaOH溶液,并密封,易拉罐会慢慢复原,原因是(用化学方程式表示)。
(4)铝粉与氧化铁粉末在高温下得到铁的反应叫做“铝热反应”,发生反应的化学方程式为。
我国农业因遭受酸雨而造成每年损失高达15亿多元。为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。
(1)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下表:
| 测试时间/h |
0 |
1 |
2 |
3 |
4 |
| 雨水的pH |
4.73 |
4.62 |
4.56 |
4.55 |
4.55 |
分析数据,回答下列问题:(已知Cl2+SO2+2H2O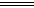 H2SO4+2HCl)
H2SO4+2HCl)
①雨水样品的pH变化的原因是(用化学反应方程式表示)____________________。
②如果将刚取样的上述雨水和自来水相混合,pH将变________(填“大”或“小”)。
(2)你认为减少酸雨产生的途径可采用的措施是________。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
| A.①②③ | B.②③④⑤ | C.①③⑤ | D.①③④⑤ |
(1)实验室制取氢氧化铁胶体的化学方程是,可用(方法)证明胶体已经制成。
(2)(4分)下列4组物质均有一种物质的类别与其它3种不同
A.CaO、Na2O、CO2、CuO B.H2、C、P、Cu
C.O2、Fe、Cu、Zn D.HCl、H2O、H2SO4、HNO3
以上四组物质中与别不同的物质依次是(填化学式)
A;B;C;D。
有人在研究硫酸亚铁受热分解反应时,作了两种假设:
⑴假设它按氯酸钾受热分解的方式来分解,反应的化学方程式为:
⑵假设它按碳酸钙受热分解的方式来分解,反应的化学方程式为:
⑶事实上,硫酸亚铁分解为氧化铁,二氧化硫,三氧化硫(分解温度为500℃左右),则反应化学方程式为:
A为只含有C、H、O三种元素的芳香烃衍生物,各物质间的相互转化关系如下图。已知:ROH+HX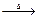 RX+H2O;E为加聚得到的高分子化合物,分子式为(C9H8O2)n;I中除含有一个苯环外还含有一个六元环,分子式为C9H8O2;H分子式为C18H16O6。
RX+H2O;E为加聚得到的高分子化合物,分子式为(C9H8O2)n;I中除含有一个苯环外还含有一个六元环,分子式为C9H8O2;H分子式为C18H16O6。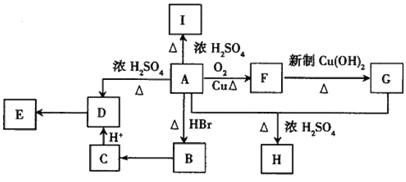
(1)写出A、E、I的结构简式:A;E;I。
(2)B→C的反应条件为____________________。
(3)A+G→H的反应类型为。
(4)有机物A的同分异构体只有两个对位取代基,既能与Fe3+发生显色反应,又能发生水解反应,但不能发生银镜反应。则此类A的同分异构体有4种。例如:
请写出另两种同分异构体。