某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。则下列说法不正确的是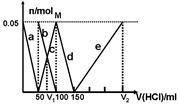
| A.M点时生成的CO2为0mol |
| B.原混合溶液中的CO32-与AlO2-的物质的量之比为1:2 |
| C.V1:V2=1:4 |
| D.a曲线表示的离子方程式为:AlO2-+H+ + H2O=Al(OH)3↓ |
下列有关物质性质的应用不正确的是
| A.液氨汽化时要吸收大量的热,可用作制冷剂 |
| B.生石灰能与水反应,可用来干燥氯气 |
| C.维生素C受热易被氧化,所以有些新鲜蔬菜生吃较好 |
| D.氮气的化学性质不活泼,可用作粮食和食品仓库的保护气 |
往浅绿色的Fe(NO3)2溶液中逐滴加入稀盐酸,溶液的颜色变化应该是
| A.变棕黄色 | B.变浅绿色 | C.变棕红色 | D.没有改变 |
能证明下列物质具有漂白性的是
| A.向加有酚酞的NaOH溶液中通入氯气,溶液立即褪色 |
| B.向加有酚酞的水中投入少量Na2O2粉末,溶液先变红,后褪色 |
| C.显红色的酚酞溶液中通入SO2后,红色褪去 |
| D.向溶有KMnO4的酸性溶液中通入SO2后,溶液紫红色褪去 |
下列不涉及氧化还原反应的是
| A.自然界中“氮的固定” | B.用铂丝蘸取NaCl溶液进行焰色反应 |
| C.食物腐败变质 | D.铜铸塑像上出现铜绿[Cu2(OH)2CO3] |
化学与科技、社会、环境密切相关。下列有关说法正确的是
| A.pH小于7的雨水被称为酸雨 |
| B.明矾溶于水可产生具有吸附性的胶体粒子,常用于饮用水的杀菌消毒 |
| C.推广使用燃煤脱硫技术,主要是为了防治SO2污染 |
| D.PM2.5是指大气中直径小于或等于2.5微米(2.5×10-6m)的细小可吸入颗粒物,其与空气形成的分散系属于胶体 |