某溶液,只可能含有以下离子中的若干种:H+、NH4+、K+、Mg2+、NO2-、CO32-、NO3-,现取两份100mL溶液进行如下实验:
①第一份加足量AgNO3溶液后,有5.84g白色沉淀产生,沉淀中加入足量稀盐酸充分反应,有棕色气体产生,沉淀颜色不变,但是质量减少0.1g;
②将产生的气体全部通入过量的澄清石灰水,又得到白色沉淀1.0g,该沉淀能溶于稀盐酸产生无色气体;
③第二份加入过量浓NaOH溶液,加热使产生的气体全部放出,用50mL0.5mol·L-1的硫酸溶液恰好完全吸收,酸也不剩余。
根据上述实验,以下推测不正确的是( )
| A.原溶液一定不存在较大浓度的H+、Mg2+ |
| B.原溶液确定含NH4+、NO2-、CO32-,且物质的量之比为5︰2︰1 |
| C.不能确定原溶液是否含有K+、NO3- |
| D.实验中产生的棕色气体遇空气颜色会加深 |
A、B、C、D、E五种短周期元素,核电荷数依次增加。只有D为金属,A与D同主族,C与E同主族,B原子最外层电子数是内层电子数的2倍,D+与C3-具有相同的电子层结构。下列说法正确的是()
A.C的氧化物都能跟碱反应
B.B的最高价氧化物的水化物是非电解质
C.C的氢化物与C的最高价氧化物的水化物能发生化合反应
D.稳定性: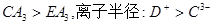
已知常温下: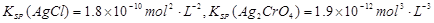 。则下列叙述正确的是()
。则下列叙述正确的是()
| A.AgCl在饱和NaCl溶液中的KSP比在纯水中的KSP小 |
B.向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明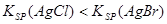 |
| C.将0.001mol·AgNO3溶液滴入0.001mol·L-1KCl和0.001mol·L-1K2CrO4混合溶液中,产生Ag2CrO4 |
| D.向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 |
在pH为4~5的环境中,Cu2+、Fe2+不生成沉淀,而Fe3+几乎完全沉淀。工业上制CuCl2是将浓盐酸加热到80℃左右,再慢慢加入粗氧化铜(含杂质FeO),充分搅拌使之溶解。现欲除去溶液中的杂质离子,下述方法中可行的是()
| A.向溶液中加入纯Cu将Fe2+还原 |
| B.向溶液中通入H2S使Fe2+沉淀 |
| C.向溶液中通入Cl2,再通入CuO粉末调节pH为4~5 |
| D.向溶液中通入Cl2,再通入NH3调节pH为4~5 |
下列选项中所涉及到的两个量一定相等的是()
| A.36gH2O与1.204×1024个O2在标准状况下所占体积 |
| B.pH相等的氨水与醋酸溶液中由水电离出的OH-浓度 |
| C.pH相等的H2SO4和CH3COOH稀释相同倍数之后溶液的pH值 |
| D.等物质的量的Al分别与足量的盐酸、烧碱溶液反应转移的电子数 |
下列各组离子在指定条件下,一定能大量共存的是()
①能使红色石蕊试纸变蓝的溶液中:K+、Na+、CO 、
、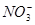 、[Al(OH)4]-
、[Al(OH)4]-
②c(H+)=10-1mol·L-1的溶液中:Cu2+、Al3+、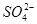
③能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH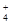 、S2-、Br-
、S2-、Br-
④水电离出的c(H)=10-13mol·L-1的溶液中:Na+、Mg2+、Cl-、SO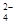
⑤在加入铝粉能产生H2的溶液中: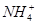 、Fe2+、SO
、Fe2+、SO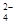 、NO
、NO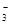
⑥在含大量Fe3+的溶液中:NH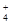 、Na+、Cl-、SCN-
、Na+、Cl-、SCN-
| A.①② | B.①③ |
| C.②④ | D.①②⑤⑥ |