一定量的铝铁合金与300 mL 2 mol/L的硝酸反应生成3.36 L NO(标准状况)和3价铁盐、铝盐等,再向反应后的溶液中加入3 mol/L NaOH溶液,使铝铁元素刚好全部转化为沉淀,则所加NaOH的体积为
| A.100 mL | B.150 mL | C.450 mL | D.无法计算 |
根据表中信息,判断下列叙述中正确的是
| 序号 |
氧化剂 |
还原剂 |
其他反应物 |
氧化产物 |
还原产物 |
| ① |
Cl2 |
FeBr2 |
/ |
Cl- |
|
| ② |
KClO3 |
浓盐酸 |
/ |
Cl2 |
|
| ③ |
KMnO4 |
H2O2 |
H2SO4 |
O2 |
Mn2+ |
A.表中①组的反应可能有一种或两种元素被氧化
B.氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2
C.表中②组反应的还原产物是KCl,电子转移数目是6e-
D.表中③组反应的离子方程式为2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.使石蕊试液变红的溶液:Na+、K+、Cl-、CO32- |
| B.1.0mol·L-1的HNO3溶液:K+、Cu2+、Cl-、SO42- |
| C.含有I-的溶液:Na+、Fe3+、Cl-、SO42- |
| D.加入Al能放出H2的溶液:Cl-、SO42-、NO3-、Mg2+ |
A、B、C均为短周期元素,A、B同周期,A、C的最低价阴离子分别为A2-、C-,A2-离子半径大于C-,B2+与C-具有相同的电子层结构。下列叙述中不正确的是
A.原子序数A>B>C B.离子半径A2->C->B2+
C.原子半径C>B>A D.最外层电子数C>A>B
用下列实验装置进行相应实验,能达到实验目的的是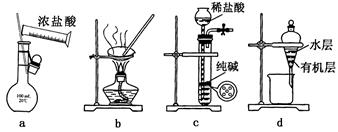
| A.用图a所示装置配制100mL0.100mol·L-1稀盐酸 |
| B.用图b所示装置蒸干FeCl3饱和溶液制备FeCl3固体 |
| C.用图c所示装置制取少量纯净的CO2气体 |
| D.用图d所示装置分离CCl4萃取碘水后已分层的有机层和水层 |
下列有关化学实验叙述正确的是
| A.容量瓶、滴定管、分液漏斗使用前都必须检查是否漏水 |
| B.用98%的浓硫酸配制100g10%的稀硫酸时,除使用量筒外还需用到容量瓶 |
| C.存放浓硝酸时,使用带橡胶塞的棕色玻璃瓶 |
| D.取用化学药品做实验,剩余药品都倒入同一废液缸中 |