常温下,向20.00mL 0.1000 mol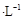 (NH4)2 SO4溶液中逐滴加入0.2000 mol
(NH4)2 SO4溶液中逐滴加入0.2000 mol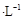 NaOH时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。
NaOH时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。
下列说法正确的是
| A.点a所示溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
| B.点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-) |
| C.点c所示溶液中:c(SO42)+ c(H+)= c(NH3·H2O )+ c(OH-) |
| D.点d所示溶液中:c(SO42)>c(NH3·H2O )>c(OH-)>c(NH4+) |
俄罗斯科学家用一种钙原子轰击含95个质子的镅原子,成功合成4个第115号元素的原子,这4个原子生成数微秒后衰变成第113号元素。下列有关叙述正确的是( )。
| A.115号元素在第六周期 |
| B.113号元素在第七周期ⅢA族 |
| C.115号和113号元素都是非金属元素 |
| D.镅元素和115号元素不在同一周期 |
在aLAl2(SO4)3和(NH4)2SO4的混合物溶液中加入b molBaCl2,恰好使溶液中的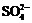 离子完全沉淀;如加入足量强碱并加热可得到c molNH3气,则原溶液中的Al3+离子浓度(mol/L)为()
离子完全沉淀;如加入足量强碱并加热可得到c molNH3气,则原溶液中的Al3+离子浓度(mol/L)为()
A.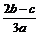 |
B.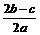 |
C.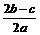 |
D.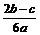 |
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
| 实验编号 |
起始浓度/(mol·L-1) |
反应后溶液的pH |
|
| c(HA) |
c(KOH) |
||
| ① |
0.1 |
0.1 |
9 |
| ② |
x |
0.2 |
7 |
下列判断不正确的是()
A. 实验①反应后的溶液中:c(K+) > c(A—) > c(OH—) > c(H+)
B. 实验①反应后的溶液中:c(OH—) = c(K+) — c(A—) =Kw/(1x10-9)mol/L
C.实验②反应后的溶液中:c(A—) + c(HA) > 0.1 mol/L
D.实验②反应后的溶液中:c(K+) = c(A—) > c(OH—) = c(H+)
糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是()
| A.脱氧过程是吸热反应,可降低温度,延长糕点保质期 |
| B.脱氧过程中铁作原电池正极,电极反应为:Fe-3e=Fe3+ |
| C.脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e=4OH- |
| D.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
一定条件下存在反应:CO(g)+H2O(g) CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器I、II、III,在I中充入1molCO和1molH2O,在II中充入1molCO2和1mol H2,在III中充入2molCO和2molH2O,700℃条件下开始反应。达到平衡时,下列说法正确的是()
CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器I、II、III,在I中充入1molCO和1molH2O,在II中充入1molCO2和1mol H2,在III中充入2molCO和2molH2O,700℃条件下开始反应。达到平衡时,下列说法正确的是()
| A.容器I、II中正反应速率相同 |
| B.容器I、III中反应的平衡常数相同 |
| C.容器I中CO的物质的量比容器II中的少 |
| D.容器I中CO的转化率与容器II中CO2的转化率之和小于1 |