25℃时,弱酸的电离平衡常数如下表,下列表述错误的是
| 弱酸 |
CH3COOH |
HCN |
H2CO3 |
| K |
1.8×10-5 |
4.9×10-10 |
K1=4.3×10-7 K2=5.6×10-11 |
A.CN-+H2O+CO2→HCN+HCO3-
B.相同温度时三种溶液的pH关系:Na2CO3> NaCN > CH3COONa
C.等体积、等物质的量浓度的CH3COOH和Na2CO3反应后的溶液呈碱性
D.amol/L HCN与bmol/L NaOH等体积混合溶液c(Na+)>c(CN-),则a一定小于b
25℃、101 kPa下,煤炭、氢气、天然气和甲醇(CH3OH)等几种燃料的热值(指一定条件下单位质量的物质完全燃烧所放出的热量)依次是33 kJ·g-1、143 kJ·g-1、56 kJ·g-1、23 kJ·g-1,则下列热化学方程式正确的是
A.C(s)+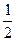 O2(g)="CO(g)" △H= -396 kJ·mol-1 O2(g)="CO(g)" △H= -396 kJ·mol-1 |
| B.CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H= -896 kJ·mol-1 |
| C.2H2(g)+O2(g)=2H2O(l)△H= -286 kJ·mol-1 |
D.CH3OH(l)+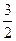 O2(g)=CO2(g)+2H2O(l)△H= +736kJ·mol-1 O2(g)=CO2(g)+2H2O(l)△H= +736kJ·mol-1 |
在5 mL 0.1 mol·L-1KI溶液中滴加0.1 mol·L-1FeCl3溶液5~6滴后,再进行下列实验,其中可证明FeCl3溶液和KI溶液的反应是可逆反应的实验是
| A.再滴加AgNO3溶液,观察是否有AgI沉淀产生 |
| B.加入CCl4振荡后,观察下层液体颜色 |
| C.加入CCl4振荡后,取上层清液,滴加AgNO3溶液,观察是否有AgCl沉淀产生 |
| D.加入CCl4振荡后,取上层清液,滴加KSCN溶液,观察是否有血红色 |
下列事实与氢键有关的是
| A.水加热到很高的温度都难以分解 |
| B.水结成冰体积膨胀,密度变小 |
| C.CH4、SiH4、GeH4、SnH4的熔点随相对分子质量的增大而升高 |
| D.HF、HCl、HBr、HI的热稳定性依次减弱 |
X、Y、Z、M是4种短周期元素,其中X、Y位于同一主族,Y与M,X与Z位于同一周期。X原子最外层电子数是其电子层数的3倍。Z原子的核外电子数比X原子少1。M是同周期中半径最大的元素(除稀有气体元素),下列说法正确的是()
| A.Y元素最高价氧化物对应水化物的化学式可表示为HYO3 |
| B.氢化物的稳定性Z >X>Y |
| C.X、Y、Z元素的气态氢化物中,Y的沸点最高 |
| D.四种元素简单离子的半径由大到小依次为Y>Z>X>M |
下列关于物质结构的说法中正确的是()
| A.BF3、HClO分子中所有原子都满足最外层8电子结构 |
| B.水分子空间构型呈V形,氨分子呈三角锥形 |
| C.D2O分子与H2O分子是所含电子总数不相等的分子 |
| D.在任何物质分子中都含有化学键 |