在常温下,0.1000mol·L-1Na2CO3溶液25mL 用0.1000mol·L-1盐酸滴定,其滴定曲线如图。对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是
| A.a点:c(CO32-)=c(HCO3-)>c(OH-) |
| B.b点:5c(Cl-)>4c(HCO3-)+4c(CO32-) |
| C.c点:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| D.d点:c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
现有等体积的Ba(OH)2、NaOH和NH3·H2O三种溶液,将它们分别与V1 L、V2 L、V3 L等浓度的盐酸混合,下列说法中正确的是( )
| A.若混合前三种溶液pH相等,将它们同等倍数稀释后,则NaOH溶液pH最大 |
| B.若混合前三种溶液pH相等,酸碱恰好完全反应,则V3>V1>V2 |
| C.若混合前三种溶液物质的量浓度相等,酸碱恰好完全反应,则V1>V2>V3 |
| D.若混合前三种溶液物质的量浓度相等,混合后溶液呈中性,则V1>V2>V3 |
下列说法正确的是
| A.25℃时NH4Cl溶液的KW大于100℃时NH4Cl溶液的KW |
| B.SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O=SO32-+2I- |
| C.加入铝粉能产生氢气的溶液中,可能存在大量的Na+、Ba2+、AlO2-、NO3- |
| D.100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 |
在常温下10mL pH=10的KOH溶液中,加入pH=4的一元酸HA溶液至pH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述正确的是
| A.c(A-)=c(K+) | B.c(H+)=c(OH-)<c(K+)<c(A-) |
| C.V总≥20mL | D.V总无法确定其范围 |
水是最宝贵的资源之一。下列表述正确的是
A.H2O的电子式为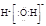 |
| B.4℃时,纯水的pH=7 |
C. 中,质量数之和是质子数之和的两倍 中,质量数之和是质子数之和的两倍 |
D.273K、101kPa,水分子间的平均距离 : : (气态)> (气态)> (液态)> (液态)> (固态) (固态) |
下列各表述与示意图一致的是
A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
B. 图②中曲线表示反应2SO2 (g) + O2(g)
图②中曲线表示反应2SO2 (g) + O2(g) 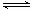 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
C.图③表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1H2C2O4溶液混合时,n(Mn2+) 随时间 的变化(注:Mn2+是该反应的催化剂)
的变化(注:Mn2+是该反应的催化剂)
D.图④中a、b曲线分别表示反应CH2=CH2 (g) + H2(g) CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化