某废水含有下列离子中的5种(忽略水的电离及离子的水解),K+、Cu2+、Al3+、Fe2+、Cl-、CO32-、NO3-、SO42-,测得各种离子的物质的量浓度相等。为探究废水的组成,某同学进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰。
②另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
③另取溶液加入BaCl2溶液,有白色沉淀生成。
根据上述实验,以下推测正确的是
| A.溶液中无法确定Al3+的存在与否 |
| B.原溶液中不含的离子为:K+、Al3+、CO32- |
| C.步骤②中可以确定Fe2+、NO3-的存在 |
| D.步骤③中共有2种钡盐沉淀 |
用惰性电极电解下列溶液,在阴、阳两极生成气体的体积比为1∶1的是( )
A.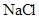 溶液 溶液 |
B.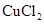 溶液 溶液 |
C. 溶液 溶液 |
D. 溶液 溶液 |
将金属钠分别投入下列物质的稀水溶液中,能生成白色沉淀的是
| A.HCl | B.K2SO4 | C.MgCl2 | D.CuCl2 |
某烃有两种或两种以上的同分异构体,其同分异构体中的某一种的一氯代物只有一种,则这种烃可能是( )
①分子中含有7个碳原子的芳香烃 ②分子中含有4个碳原子的烷烃 ③分子中含有12个氢原子的烷烃④分子中含有8个碳原子的烷烃( )
| A.①② | B.②③ | C.③④ | D.②④ |
生铁和钢的主要区别是()
| A.生铁和钢的主要成分都是铁,但二者的含碳量不同,性能也不同。 |
| B.生铁和钢都是碳的合金 |
| C.生铁就是含杂质较多的钢,钢就是含杂质较少的生铁。 |
| D.生铁是混合物,钢是纯净物 |
高温下丁烷完全裂化生成四种气体,将混合气体用溴水处理后,剩余气体的平均分子质量为21.6,则原四种混合气体的平均分子质量是
| A.21.6 | B.27.6 | C.29 | D.36.4 |