在密闭容器中,放入镍粉并充入一定量CO气体,一定条件下发生反应:Ni(s)+4CO(g)  Ni(CO)4(g),已知该反应在25℃和80℃时的平衡常数分别为5×104和2,下列说法正确的是
Ni(CO)4(g),已知该反应在25℃和80℃时的平衡常数分别为5×104和2,下列说法正确的是
| A.上述生成Ni(CO)4(g)的反应为吸热反应 |
| B.恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动 |
| C.在80℃时,测得某时刻,Ni(CO)4 、CO浓度均为0.5 mol/L,则此时v正<v逆 |
| D.恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,CO 的百分含量将增大 |
实验室可以通过乙醇分子内的脱水反应制乙烯,反应方程式如下: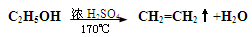
下列醇类物质中也能发生类似的脱水反应生成烯烃的是
A.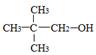 |
B.CH3OH | C.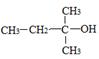 |
D.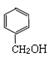 |
在 分子中,处于同一平面上的原子数最多可能是
分子中,处于同一平面上的原子数最多可能是
| A.15个 | B.16个 | C.17个 | D.18个 |
下列反应中,反应后固体物质增重的是
| A.乙醇蒸汽通过灼热的CuO粉末 | B.二氧化碳通过Na2O2粉末 |
| C.铝与Fe2O3发生铝热反应 | D.将锌粒投入Cu(NO3)2溶液 |
用下列实验装置进行的实验中,不能达到相应实验目的的是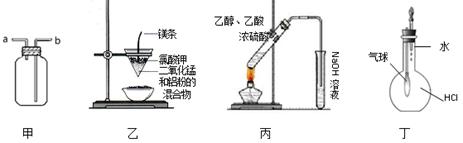
| A.装置甲:气体从a口进入,收集NH3 | B.装置乙:可制得金属锰 |
| C.装置丙:实验室制取乙酸乙酯 | D.装置丁:验证HCl气体在水中的溶解性 |
为提纯下列物质(括号内为杂质).所选试剂及方法均正确的是
| 选项 |
物质(括号内为杂质) |
除杂试剂 |
方法 |
| A |
溴苯(溴) |
CCl4 |
分液 |
| B |
硝基苯(NO2) |
NaOH溶液 |
分液 |
| C |
乙烷(乙烯) |
氢气 |
洗气 |
| D |
乙醇(乙酸) |
NaOH溶液 |
分液 |