已知:Ki1(H2CO3)> Ki1(H2S)。现有以下试剂:盐酸、醋酸、苯酚、碳酸钙、醋酸钠溶液、硫化钠溶液,用下图所示装置进行下列实验,无法达到实验目的的是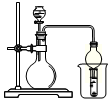
| A.比较醋酸、苯酚、碳酸的酸性 |
| B.比较盐酸、醋酸、碳酸的酸性 |
| C.比较醋酸、氢硫酸、碳酸的酸性 |
| D.比较盐酸、碳酸、氢硫酸的酸性 |
在水溶液中 能大量共存,且加入过量稀硫酸溶液时,有气体生成的是
能大量共存,且加入过量稀硫酸溶液时,有气体生成的是
| A.Na+、Ag+ 、CO32-、Cl- | B.K+、Ba2+ 、SO42-、Cl- |
| C.Na+、K+ 、CO32-、Cl- | D.Na+、K+ 、Cl-、 SO42— |
下列离子反应方程式,书写正确的是
| A.向碳酸钠溶液中加盐酸 CO32- + 2H+ = H2O +CO2 ↑ |
| B.向稀硫酸溶液中投入铁粉 2Fe +6H+ = 2Fe3+ +3H2 ↑ |
| C.向盐酸中投入碳酸钙 CO32- + 2H+ = H2O +CO2 ↑ |
| D.氢氧化钡溶液中加入硫酸 H+ + OH- =H2O |
下列电离方程式,书写正确的是
A. Al2(SO4)3 =2Al3+ +3SO42-B.AlCl3 = Al3+ Cl3-
D. Mg(NO3)2 = Mg+2 +2NO3-D.KMnO4 =K+ +Mn7+ +4O2-
用特殊方法把固体物质加工到纳米级(1nm~100nm)的超细粉末粒子,然后制得纳米材料。下列分散系中的分散质的粒子的大小和这种纳米粒子大小具有相同的数量级的是
| A.溶液 | B.悬浊液 | C.胶体 | D.乳浊液 |
胶体的最本质的特征是
| A.丁达尔效应 | B.可以通过滤纸 |
| C.布朗运动 | D.分散质颗粒的直径在1nm~100nm之间。 |