某化学课外活动小组的同学在学习NH3的性质时讨论:既然NH3具有还原性,能否像H2那样还原CuO呢?于是他们设计了如下实验装置(夹持装置未画出)进行实验。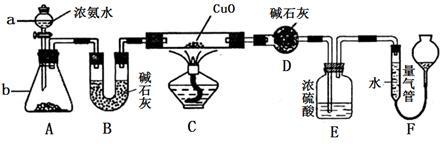
请回答下列问题:
(1)仪器a的名称为______________;仪器b中可选择的试剂为______________;
(2)实验中观察到装置C中黑色CuO粉末变为红色固体,干燥管D增重,量气管内收集到无色无味的单质气体,上述现象可以证明NH3具有________性,写出相应的化学方程式_____________;
(3)E装置中浓硫酸的作用是________________________________
(4)读取气体体积前,应对装置F进行的操作是:________________________若读数时,量气管中的液面低于水准管的液面,则量气管中气体的体积将_____。(填“偏大”、“偏小”或“不变”)。
(5)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物,在酸性溶液中,Cu+易发生自身的氧化还原反应(2Cu+ →Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O: 。
(6)此套实验装置还可用于测定氨气的分子组成。若实验完毕,测得干燥管D增重m克,装置F测得气体的体积为n升(已折算成标准状况),则氨分子中氮、氢的原子个数比为________(用含m、n字母的代数式表示)
Ⅰ.实验室常用以下几种方法制取氯气
(1)二氧化锰与浓盐酸反应制氯气,写出其反应的离子方程式_________________________。
(2)高锰酸钾与浓盐酸反应制氯气,写出其反应的化学方程式_________________________。
(3)氯酸钾与浓盐酸反应制氯气,该反应中氧化产物与还原产物的物质的量之比为___________。
Ⅱ.某研究性学习小组利用下列装置制备漂白粉,并进行漂白粉有效成分的质量分数测定。
(1)装置④中的x试剂为_________________________;
(2)装置③中发生反应的化学方程式为___________________________________,该反应是放热反应,反应温度较高时有副反应发生,改进该实验装置以减少副反应发生的方法是____________________________;
(3)测定漂白粉有效成分的质量分数:称取1.000 g漂白粉于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.1000 mol·L-1 KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为:
3ClO-+ I-= 3Cl-+ IO3-IO3-+ 5I-+ 3H2O = 6OH-+ 3I2
实验测得数据如下表所示。
| 滴定次数 |
1 |
2 |
3 |
| KI溶液体积/mL |
19.98 |
20.02 |
20.00 |
该漂白粉中有效成分的质量分数为_______________;若滴定过程中未充分振荡溶液局部变浅蓝色时就停止滴定,则测定结果将_______________(填“偏高”、“偏低”或“无影响”) 。
为测定某亚硫酸钠样品的纯度,甲同学称取10.0g固体,进行如下实验: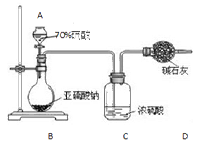
(1)实验仪器A的名称为。
(2)装置C中浓硫酸的作用是。
(3)若测得装置D中干燥管实验前后增重了4.8g,由此可计算出该样品中亚硫酸钠的纯度为。
(4)该实验方案存在明显缺陷,会使测定结果(填“偏高”或“偏低”)。为使结果准确,你的建议是。
(8分)阅读下列实验内容,根据题目要求回答问题。
实验室中有一未知浓度的稀盐酸,某学生用0.100mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。请完成下列填空:
| 实验编号 |
待测盐酸的体积(mL) |
NaOH溶液的浓度(mol·L-1) |
滴定完成时,NaOH溶液滴入的体积(mL) |
| 1 |
20.00 |
0.10 |
24.18 |
| 2 |
20.00 |
0.10 |
23.06 |
| 3 |
20.00 |
0.10 |
22.96 |
(1)滴定达到终点的标志是。
(2)根据上述数据,可计算出该盐酸的浓度约为(保留小数点后叁位)。
(3)若滴定结束时,碱式滴定管中的液面如图所示,终点读数为mL。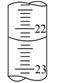
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有。
A.用酸式滴定管取20.00 mL待测盐酸,使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消失
蒸馏是实验室制备蒸馏水的常用方法。下图是实验室制取蒸馏水的常用装置。
(1)图中明显的错误是。
(2)仪器A的名称是,仪器B的名称是。
(3)实验时,A中除加入适量自来水外,还需加入少量,其作用是。
下列实验装置不能达到实验目的的是