以石灰石、赤铁矿为原料,进行金属铁的冶炼,各物质之间的转化关系如下图所示。
试回答:
Ⅰ.写出步骤①和③的化学方程式:① 、③ 。
Ⅱ.上述流程中可循环利用的物质是 (填物质名称)。
Ⅲ.B中还含有未煅烧完的碳酸钙。检验方法Ⅰ:取样, ,证明B残渣中含有碳酸钙;检验方法Ⅱ: ,证明B残渣中含有碳酸钙。
某化合物化学式为K2R2O7,R的化合价是_____
某化学兴趣小组探究常温下碳酸钠饱和溶液的酸碱度。
[猜想与假设]溶液的pH可能是(填入你的猜想与假设):
①pH>7;②pH;③pH。
[设计与实验]小方、小钟、小陈三位同学进行了如下实验:
小方:取pH试纸于玻璃片上,用玻璃棒蘸取碳酸钠溶液沾在pH试纸上,测得pH>7。
小钟:取pH试纸于玻璃片上,先用蒸馏水润湿pH试纸,然后用玻璃棒蘸取碳酸钠溶液沾在pH试纸上,测得pH>7。
小陈:取pH试直接浸入碳酸钠溶液中,测得pH>7。
[评价]以上三位同学中操作规范的是同学,
其余两位同学操作上的错误是;。
[结论]从物质的类别看,碳酸钠是一种(填“酸”或“碱”或“盐”),它的溶液显碱性,说明显碱性的溶液(填“一定”或“不一定”)是碱的溶液。
[应用]根据碳酸钠溶液显碱性,说出它在日常生活中的一种用途:。
下图化学反应的溶液颜色变化体现了“魔法世界,魅力化学”,请回答: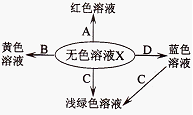
(1)溶液X是(填“酸”、“碱”、“盐”),试剂A的名称是。
(2)若X是稀硫酸,B是氧化物,则B的化学式为。
(3)若X是稀盐酸,C是单质,则C的名称是。
(4)若X是稀硫酸,D是碱,则X与D反应的化学方程式为。
某同学用提取的精盐配制100g质量分数为11.7%的氯化钠溶液,请你参与完成:
①计算:氯化钠的质量为g,水为g。
②称量:用托盘天平称量,氯化钠应放在(填“左盘”或“右盘”)。
③溶解:用量筒来量取所需的水(水的密度为1g/cm3),量筒的规格是(从下列中选用:10mL、25 mL、50 mL、100 mL)。量取液体时,量筒必须放平,视线与液体的_________保持水平。溶解氯化钠要用到玻璃棒,其作用是。
④反思:若称取的氯化钠中含有水分,则所配制的溶液溶质质量分数会(填“偏大”、“偏小”或“无影响”)。
通过晾晒海水或煮盐井水、盐湖水等方法,均可得到含有较多杂质的粗盐,这种方法属于__________变化(填“物理”或“化学”)。粗盐经过__________、过滤、__________[可得到初步提纯,再通过化学方法获得精盐。