下列事实中能说明亚硝酸是弱电解质的是
| A.用HNO2溶液作导电试验,灯光较暗 |
| B.HNO2是共价化合物 |
| C.亚硝酸不与氯化钠反应 |
| D.常温下0.1 mol・L-1亚硝酸溶液的c(H+)为7.1×10-3 mol·L-1 |
已知在t1、t2温度下水的电离平衡曲线如图所示,则下列说法中不正确的是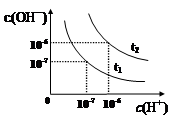
| A.t1<t2 |
| B.一定温度下,改变水溶液中c(H+)或 c(OH-)的浓度,Kw不会发生变化 |
| C.t2温度pH值为2的HCl溶液中,水电离出的c(H+)=1×10-10mol·L-1 |
| D.将t1温度下0.1 mol·L-1的盐酸稀释,溶液中所有离子的浓度均相应减小 |
常温下,0.1 mol·L-1某一元酸(HA)溶液中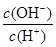 =10-8,下列叙述正确的是
=10-8,下列叙述正确的是
A.该一元酸溶液的pH=1
B.该溶液中由水电离出的H+浓度为c(H+)=1.0×10-11 mol·L-1
C.该溶液中水的离子积常数为1.0×10-22
D.在0.1 mol·L-1某一元酸(HA)溶液中,水的电离被促进
家用炒菜锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不会发生的化学反应是
| A.4Fe(OH)2+2H2O+O2=4Fe(OH)3 | B.2Fe+2H2O+O2=2Fe(OH)2 |
| C.2H2O+O2+4e-=4OH- | D.Fe-3e-=Fe3+ |
常温下,pH值为11的NaOH溶液与pH值为11的CH3COONa溶液中,水电离的c(OH-)之比为
| A.1∶1011 | B.1∶103 | C.1∶108 | D.108∶1 |
有甲、乙、丙三瓶等体积、等物质的量浓度的NaOH溶液,若将甲蒸发掉一半水(设溶质未变);乙中通入一定量的CO2;丙不做任何改变进行对照,以甲基橙作指示剂,用相同浓度的盐酸滴定,分别达到终点消耗盐酸的体积是
| A.V甲>V乙=V丙 | B.V甲>V丙>V乙 |
| C.V甲=V乙>V丙 | D.V甲=V乙=V丙 |