由已知电离常数判断,下列关于SO2与Na2CO3(aq)反应的离子方程式的书写中,不合理的是
| 酸 |
电离常数 |
| 碳酸 |
K1=4×10-7 K2=5.6×10-11 |
| 亚硫酸 |
K1=1.54×10-2 K2=1.02×10-7 |
A.SO2+H2O+2CO32-="2" HCO3-+SO32-
B.SO2+H2O+CO32-=H2CO3+SO32-
C.2SO2+2H2O+CO32-=H2CO3+2 HSO3-
D.SO2+H2O+CO32-= HCO3-+HSO3-
下图是立方烷(cunane)的球棍模型,下列有关说法不正确的是( )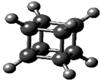
| A.它的一氯代物只有一种同分异构体 |
| B.它的二氯代物有三种同分异构体 |
| C.它是一种极性分子 |
| D.它与苯乙烯(C6H5—CH=CH2)互为同分异构体 |
分子式为C7H16的烷烃中,含有3个甲基的同分异构体的数目是()
| A.2 | B.3 | C.4 | D.5 |
下列分子的所有原子肯定不在同一平面内的是()
| A.ClCH=CHCl | B.CO2 | C.CH≡CH | D.CH3C≡CCH3 |
四氯乙烯对环境有一定的危害,干洗衣服的干洗剂主要成分是四氯乙烯;家用不粘锅内侧涂覆物质的主要成分是聚四氟乙烯。下列关于四氯乙烯和聚四氟乙烯的叙述中正确的是( )
| A.它们都属于纯净物 |
| B.它们的分子中都不含氢原子 |
| C.它们都能使酸性高锰酸钾溶液褪色 |
| D.它们都可由乙烯只发生加成反应得到 |