为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验)。
实验步骤:
1.在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接。
2.当丙装置中FeC12溶液变黄时,停止加热。
3.打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
4.在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后,停止。
5.更新丙中试管,打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
回答下列问题:
(1)甲中发生反应的化学方程式为______________________。
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是____________。
(3)实验中,证明氧化性Fe3+>SO2的离子方程式为_____________。
(4)有I、II、III三组同学分别完成了上述实验,实验结果如下:
| |
步骤3溶液中含有的离子 |
步骤5溶液中含有的离子 |
| I |
既有Fe3+又有Fe2+ |
有SO42- |
| Ⅱ |
有Fe3+无Fe2+ |
有SO42- |
| Ⅲ |
有Fe3+无Fe2+ |
有Fe2+ |
上述实验结果一定能够证明Cl2>Fe3+>SO2的是______(填“I”、“II”或“III”)。
(本题12分)海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列;从海水中提取食盐和溴的过程如下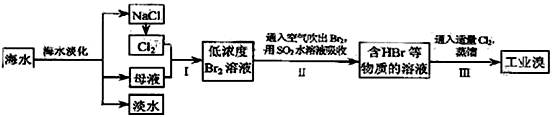
(1)请列举海水淡化的两种方法: 、 。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为
。
(3)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 ,由此反应可知,除保护环境外,在工业生产中应解决的主要问题是 。
(4)某化学研究性学习小组为了解从工业生产中提纯溴的方法,查阅了有关资料,Br2的沸点为 59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图:
请你参与分析讨论:
①图中仪器B的名称: 。
②整套实验装置中仪器连接均不能使用橡胶塞和橡胶管,其原因是 。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件: 。
④ C中液体颜色为 。为除去产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是 。
铁在冷的浓硫酸中能发生钝化。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。实验室现有下列试剂:0.01 mol/L 酸性KMnO4溶液、0.1 mol/L KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水。请你协助他们探究所得溶液和气体的成分。
【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中可能含有中的一种或两种。
【实验探究】
| 实验操作 |
预期现象 |
结论 |
|
| 验证猜想Ⅰ |
步骤①:取少量0.01 mol/L 酸性KMnO4溶液,滴入所得溶液 |
||
| 步骤②: |
含有Fe3+ |
||
| 验证猜想Ⅱ |
将所得气体通入如下装置 |
含有两种气体 |

【问题讨论】
有同学提出,若另外选用KSCN溶液,则仅利用KSCN和H2O2两种溶液即可完成猜想Ⅰ的所有探究,判断该方法是否正确并进行评价:
。
为了证明CO具有还原性,有人设计了如图所示的实验.
(1)装置B的最适宜的试剂是.
(2)装置D中发生反应的化学方程式是.
(3)必须用装置C吸收除去气体中水蒸气的理由是.
(4)若根据F中石灰水变浑浊的现象也能确认CO具有还原性,应在下图中装置与之间连下图所示的装置(填序号).
油条是一种深受群众喜爱的传统食品,在百姓早餐桌上一直占有重要位置。但油条中铝含量超标问题十分普遍,是影响群众健康的食品安全隐患。从2009年5月下旬开始,浙江省的油条加工停用含铝食品的添加剂,逐步转换为无铝添加剂配方和工艺,从而保证百姓吃上安全、放心的油条。油条无铝配方由碳酸氢钠(小苏打)、碳酸氢铵(臭粉)组成。为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如下装置进行实验。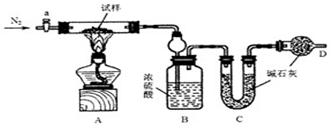
实验过程:
①按图组装仪器,检查装置的气密性;
②将试样m1g放入硬质玻璃管中,装置B、C、D中药品如图,已知加药品后装置B的质量
为m2g、装置C的质量为m3g;
③打开活塞a,通N2一段时间后,关闭活塞a,点燃酒精灯加热试样,直到B装置中无气泡冒出后,打开活塞a向装置中通入N2,一段时间后,撤掉酒精灯,关闭活塞a;
④称得装置B的质量为m4g、装置C的质量为m5g。
请回答以下问题:
(1)装置A中发生反应的化学方程式为,
。
(2)装置D的作用为防止空气中进入装置C中。
装置C的作用为。
(3)实验过程中第二次通入N2的目的是把装置中产生的排出,使其被装置B和装置C完全吸收。
(4)用下列各项所提供的数据能计算出w(NaHCO3)的是()(填写序号)
| 序号 |
a |
b |
c |
d |
e |
| 数据 |
m1、m2、m3 |
m2、m3、m4、m5 |
m1、m2、m4 |
m1、m4、m5 |
m1、m3、m5 |
(5)实验结束后发现装置A中硬质玻璃管右端有水珠,你认为利用实验中所提供的数据还能否得到准确的w(NaHCO3)(填“能”或“不能”)。
某化学小组利用浓盐酸和二氧化锰在加热条件下制取氯气,并利用氯气进行有关的探究实验 ,制取氯气的装置如图I和Ⅱ。
,制取氯气的装置如图I和Ⅱ。
(1)制取氯气的反应的离子方程式;
(2)装置Ⅱ中小试管的作用为;
(3)装置I与装置Ⅱ比较,装置I的主要优点为:。
(4)将生成的氯气通入水中,可制得氯水,氯水见光易分解生成气体。
(5)氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能,请利用中学实验室常见试剂,设计实验,得出正确结论。
| 提出问题 |
收集资料 |
提出假设 |
验证假设 |
得出结论 |
| 氯水中何种物质能使湿润的红色布条褪色? |
①Cl2有强氧化性 ②Cl2与冷水反应生成盐酸和HClO ③HClO有强氧化性 |
①。 ②盐酸使布条褪色。 ③。 ④H2O使布条褪色 |
验证假设①:把红色干布条放入充Cl2的集气瓶,布条不褪色; 验证假设②:。 验证假设④:把红色布条放在水里,布条不褪色。 |
使红色布条褪色的物质是。 |