金属用途广泛,其结构和性质等是化学的重要研究内容.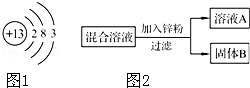
(1)如图1是铝的原子结构示意图.下列说法不正确的是 .
| A.铝原子在反应中易得电子 |
| B.在化合物中铝通常显+3价 |
| C.铝是地壳中含量最多的金属元素 |
| D.铝可作导线是由于它具有良好的导电性 |
(2)某化学小组用一定量NaNO3和Cu(NO3)2混合溶液进行了图2实验,并对溶液A和固体B的成分进行了分析和实验探究.
[提出问题]溶液A中的溶质可能有哪些?
[作出猜想]①只有Zn(NO3)2②Zn (NO3)2、Cu(NO3)2 ③Zn (NO3)2、NaNO3
[交流讨论]合理的猜想是 (填标号),其理由是 .
[实验探究]通过以下实验可确定固体B的成分,请将表填写完整.
| 实验步骤 |
现 象 |
有关反应的化学方程式 |
| 取固体B少量,滴加 |
有气泡产生 |
(或 ) |
(3)在炼铁炉中焦炭的作用是通过燃烧提供能量和 ;有铁生成的化学方程式为 .
(4)黄铜(Cu﹣Zn合金)20g与100g稀硫酸在烧杯中恰好完全反应,反应后测得烧杯中剩余物的总质量为119.6g.计算稀硫酸中溶质的质量分数(计算结果精确到0.1%)
某化学兴趣小组设计了一组有关气球变化的实验,三套装置如下图:

(1)甲装置:若该装置的气密性良好,则向a中加水会看到。
(2)乙装置:若锥形瓶中装有生石灰,由分液漏斗加入少量水,则气球胀大的主要原因是_________。
(3)丙装置:若锥形瓶中盛满CO2,通过发生化学变化使气球胀大,且生成物之一属于盐类,则分液漏斗中的液体可以是________。该反应的化学方程式为。
某学校兴趣小组对食用纯碱和食用小苏打两种粉末进行以下探究。
【查阅资料】两者的热稳定性:
(1)食用纯碱受热不分解。
(2)食用小苏打270 ℃时完全分解为碳酸钠、二氧化碳、水
【实验探究】
(1)验证两种粉末的稳定性
在老师的指导下,该小组按图1所示装置进行实验操作,观察到(填“甲”或“乙”)烧杯中澄清石灰水变浑浊,小试管中发生反应的化学方程式为 __________,装置中棉花的作用是。写出食用小苏打的一点用途_______________________。
(2)测定食用纯碱粉末的纯度
取食用纯碱粉末试样(假设只含少量氯化钠)22g放入烧杯中,向烧杯中加入200g足量的稀盐酸,充分反应后气体全部逸出,烧杯中剩余物的总质量为213.2g。
①反应生成CO2的质量为g。
②通过计算确定食用纯碱粉末中Na2CO3的质量分数 (结果保留一位小数,下同)。
③如果测得的结果比实际纯度高,可能的原因是(答一种即可)。
④求反应后所得溶液中溶质的质量分数(请写出计算过程)。
阅读以下材料,回答下列问题:
材料1:某市酒吧发生一起特大火灾。该事故的起因是几个年轻人在酒吧内燃放烟花,引燃聚氨酯泡沫塑料天花板,聚氨酯泡沫塑料燃烧产生大量有毒烟气,造成人员中毒伤亡。
材料2:氢氧化镁是一种新型的阻燃剂。当温度达到380℃时,氢氧化镁会分解出水蒸气,同时生成耐高温的氧化镁固体。利用氢氧化镁这一性质,将它添加在塑料等易燃性材料中能起阻燃作用。
(1)燃着的烟花在引发这场火灾中所起的作用是。(填序号)
A.提供氧气
B.提供可燃物
C.使可燃物的温度达到着火点
(2)根据灭火原理初步分析氢氧化镁能作阻燃剂的原因,(答一点)
氢氧化镁受热分解的化学方程式为。
阅读下面的材料,回答下列问题:
自从非典型肺炎在我国部分地区出现以来,过氧乙酸作为高效消毒剂被广泛使用。过氧乙酸在常温下是一种无色有刺激性气味的液体,易挥发,易溶于水和醋酸。它对呼吸道黏膜有刺激性,高含量的过氧乙酸溶液对皮肤有腐蚀性。一般商品过氧乙酸是40%的醋酸溶液,使用前通常先用蒸馏水等将其稀释,消毒时可用喷雾法消毒,也可将其配制成0.2%的水溶液洗手消毒。过氧乙酸不稳定,易分解生成无毒物质,若用喷雾法消毒,过氧乙酸在半小时内就可完全分解。
(1)在过氧乙酸的质量分数为40%的醋酸溶液中,溶质是,溶剂是。
(2)分别指出过氧乙酸的一点物理性质和一点化学性质。
物理性质:;
化学性质:。
(3)100 g过氧乙酸的质量分数为0.2%的洗手液中含过氧乙酸g。
(4)不慎让高含量的过氧乙酸溶液沾到皮肤上,应做怎样的处理?
(5)根据过氧乙酸的性质,用过氧乙酸喷雾消毒过的房间,人若要进去,应注意什么?
氯气(Cl2)是黄绿色气体,溶于水时部分以Cl2分子存在于溶液中,部分与水反应Cl2 + H2O =" HCl" + HClO。产物中,次氯酸(HClO)是一种弱酸。氯气溶于水所得溶液称为氯水,它具有很强的漂白性。把品红试纸(染有品红颜料的滤纸)放入氯水中,品红试纸褪色。晓红同学对“氯水使品红试纸褪色”产生浓厚兴趣,她所在的学习小组进行了如下探究,请你一起来完成:
【提出问题】氯水中的什么成分使品红试纸褪色?
【猜想】猜想1:氯水中的水使品红试纸褪色;
猜想2:氯水中的Cl2使品红试纸褪色;
猜想3:氯水中的盐酸使品红试纸褪色;
猜想4:氯水中的__________使品红试纸褪色。
【实验探究】
| 实验操作 |
实验现象 |
结论 |
| ①把品红试纸放入水中 |
猜想1不成立 |
|
| ② |
试纸不褪色 |
猜想2不成立 |
| ③ |
试纸不褪色 |
猜想3不成立 |
【结论】学习小组通过讨论,找到了氯水中使品红试纸褪色的物质。
【反思】向氯水中滴加几滴紫色石蕊试液,会观察到的现象是。
【拓展】铁能在氯气中燃烧生成氯化铁,请写出该反应的化学方程式。