已知:CO2(g)+3H2(g)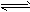 CH3OH(g)+H2O(g) △H="-49.0" kJ/mol。一定条件下,向体积为1L的密闭容器中充入1 mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如下图所示。下列叙述中,正确的是
CH3OH(g)+H2O(g) △H="-49.0" kJ/mol。一定条件下,向体积为1L的密闭容器中充入1 mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如下图所示。下列叙述中,正确的是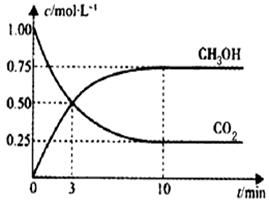
| A.升高温度能使平衡向正反应方向移动 |
| B.从反应开始到平衡,v(H2)=0.075mol·L-1·min-1 |
| C.3 min时,V(CO2)正 = V(CH3OH)逆 |
| D.反应达到平衡状态时,CO2的平衡转化率为75% |
[2012·江门调研]下列热化学方程式中,正确的是()
A.甲烷的燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890.3kJ·mol-1
B.含20.0g的NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.4 kJ·mol-1
D.已知:2Zn(s)+O2(g)=2ZnO(s)ΔH=-701.0kJ/mol
2Hg(l)+O2(g)=2HgO(s)ΔH=-181.6kJ/mol
则Zn(s)+HgO(s)=ZnO(s)+Hg(l)ΔH=-259.7 kJ·mol-1
[2012·北京丰台一模]根据碘与氢气反应的热化学方程式,下列判断正确的是()
① I2(g)+H2(g)  2HI(g)△H=-9.48 kJ·mol-1
2HI(g)△H=-9.48 kJ·mol-1
② I2(s)+H2(g)  2HI(g)△H=+26.48 kJ·mol-1
2HI(g)△H=+26.48 kJ·mol-1
| A.254g I2(g)中通入2g H2(g),反应放热9.48 kJ |
| B.当反应②吸收52.96kJ热量时转移2mole一 |
| C.反应②的反应物总能量比反应①的反应物总能量低 |
| D.1 mol固态碘与1 mol气态碘所含能量相差17.00 kJ |
向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是
A.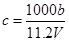 |
B.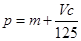 |
C.n=m+17Vc | D.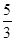 m<p< m<p< |
25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是 ( )
A.2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(1)△H=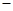 57.3 kJ/mol 57.3 kJ/mol |
B.KOH(aq)+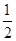 H2 SO4(aq)= H2 SO4(aq)=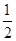 K2SO4(aq)+H2O(l)△H= K2SO4(aq)+H2O(l)△H=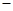 57.3kJ/mol 57.3kJ/mol |
C.C8H18(I)+ O2(g)=8CO2(g)+9H2O△H= O2(g)=8CO2(g)+9H2O△H=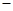 5518 kJ/mol 5518 kJ/mol |
D.2C8H18(g)+25O2(g)=16CO2(g)+18H2O(1)△H=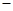 5518 kJ/mol 5518 kJ/mol |
25°C时,几种弱酸溶液的PH如下表所示:
| 弱酸 |
CH3COOH |
H2SO3 |
HCN |
| 物质的量浓度mol/L |
0.01 |
0.01 |
0.01 |
| PH |
3.4 |
2.3 |
5.6 |
下列有关说法正确的是
A.相同PH的CH3COOH与HCN溶液中水电离的氢离子浓度CH3COOH溶液中的大
B.物质的量浓度相同的CH3COONa与NaCN溶液中,各离子浓度之和两者相等。
C.25°C时,HCN溶液的电离平衡常数(Ka)与NaCN溶液的水解平衡常数(K)存在
如下关系:Ka ·K = Kw
D.0.01mol/L的Na2SO3溶液与0.01mol/L的CH3COONa溶液相比,一定是后者的碱性强