日常饮用水中NO3一的含量是水质卫生检验的重要标准之一,达到一定浓度时会对人类健康产生危害,为了降低饮用水中NO3一的浓度,某兴趣小组提出如下方案:
请回答下列问题:
(1)该方案在调节pH时,若pH过大或过小都会造成 的利用率降低。
(2)已知过滤后得到的滤液中几乎不含铝元素。①在溶液中铝粉和NO3一反应的离子方程式为 。
②滤渣在空气中煅烧过程中涉及的相关反应方程式为
(3)用H2催化还原法也可降低饮用水中NO3—的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为 。
(4)饮用水中的NO3- 主要来自于NH4+。已知在微生物作用下,NH4+ 经过两步反应被氧化成NO3- 。两步反应的能量变化示意图如下:
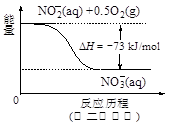
试写出1 mol NH4+ (aq)全部氧化成NO3- (aq)的热化学方程式是 。
(5)固体a熔融电解时阴极反应式为
有一固体混合物,可能由NaI、KCl、Na2CO3、Na2SO4、CaCl2、Cu(NO3)2中的一种或几种组成,为了检验所含的物质,做了以下实验:
①取少许固体溶于水,得到无色透明溶液;②往此溶液中滴加氯化钡溶液,有白色沉淀生成;③过滤,往沉淀中加入足量的稀硝酸,发现沉淀没有全部溶解且有无色无味的气体生成。④往滤液中加入足量的新制的氯水,再加入少许汽油,振荡,静置,上层液体呈紫红色。
(1)试判断:固体混合物中肯定含有,一定没有,可能含有________________。
(2)对可能含有的物质,如何进行实验以进一步检验。
(3)实验④中发生的化学反应属于反应(填反应类型),主要实验操作名称叫
Ⅰ.(1)以下物质:①液氨 ②碳酸钙③酒精 ④饱和食盐水 ⑤铜 ⑥硫酸 ⑦盐酸,属于电解质的有 (填编号);属于非电解质的有_____________;
(2)19.6g H2SO4分子所含氢原子数与 L (标准状况下)CH4所含氢原子数相等;
Ⅱ.有A、B、C三种元素,已知A元素原子的K层和M层电子数相同;B元素原子的L层比K层电子数多5个;C元素的+3价阳离子和氖原子具有相同的电子数。
(1)写出A的原子结构示意图________;元素C的原子核组成符号________。
(2)B的阴离子结构示意图________;A、B组成的化合物的化学式。
(12分)某化学课外小组为测定空气中CO2的含量,进行了如下实验:
(1)配制0.100 0 mol·L-1和0.010 00 mol·L-1的标准盐酸。
(2)用0.100 0 mol·L-1的标准盐酸滴定未知浓度的Ba(OH)2溶液10.00 mL,结果用去盐酸19.60 mL。
(3)用测定的Ba(OH)2溶液吸收定量空气的CO2。取Ba(OH)2溶液10.00 mL,放入100 mL容量瓶里,加水至刻度线。取出稀释后的溶液放入密闭容器内,并通入10 L标准状况下的空气,振荡,这时生成沉淀。
(4)过滤上述所得浊液。
(5)取滤液20.00 mL,用0.010 00 mol·L-1的盐酸滴定,用去盐酸34.80 mL。请回答下列问题:
①配制标准盐酸时,需用下列哪些仪器________;
| A.托盘天平 |
| B.容量瓶 |
| C.酸式滴定管 |
| D.量筒 |
E.烧杯
F.胶头滴管
G.玻璃棒
②滴定操作中,左手__________,右手__________,眼睛________________________。
③Ba(OH)2溶液的物质的量浓度是________________________________________;
④过滤所得浊液的目的是_________________________________________________;
⑤此空气样品中含CO2的体积分数为______________________________________。
在一定温度下,将2 mol A和1 mol B两种气体相混合于体积为2 L的某密闭容器中(容积不变),发生如下反应:3A(g)+B(g)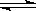 xC(g)+2D(g)ΔH<0,2 min末反应达到平衡状态(温度不变),生成了1mol D,并测得C的浓度为0.5 mol·L-1,请填写下列空白:
xC(g)+2D(g)ΔH<0,2 min末反应达到平衡状态(温度不变),生成了1mol D,并测得C的浓度为0.5 mol·L-1,请填写下列空白:
(1)x的值等于________________。
(2)该反应的化学平衡常数K=________,升高温度时K值将________(选填“增大”、“减小”或“不变”)。
(3)A物质的转化率为__________________。
(4)若维持温度不变,在原平衡混合物的容器中再充入2mol C和2mol D,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入A的物质的量为________ mol。
一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,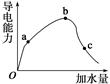
请回答:
(1)O点为什么不导电:_______________________________。
(2)a、b、c三点溶液的pH由小到大的顺序是______________。
(3)H+的物质的量最大的是________(填“a”、“b”或“c”)。
(4)若使c点溶液中的c(CH3COO-)增大,可以采取下列措施中的________(填序号)。
| A.加热 | B.加很稀的NaOH溶液 |
| C.加NaOH固体 | D.加水 |
E.加入锌粒